Координационные соединения
Координационные (комплексные) соединения - это соединения с донорно-акцепторной связью. Координационные соединения состоят из ионов внутренней и внешней сфер. В формуле комплексного соединения ионы внутренней сферы заключаются в квадратные скобки. Ионы внутренней сферы - комплексные ионы - состоят из комплексообразователя (центрального иона) и лигандов. Число лигандов во внутренней сфере комплекса называется координационным числом. Дентатность лиганда - это число связей , которыми данный лиганд соединен с комплексообразователем.
Пример: K3[Fe(CN)6]
1. Ионы внешней сферы - 3К+
2. Ион внутренней сферы - [Fe(CN)6]3-
3. Комплексообразователь - Fe3+
4. Лиганд - CN-, его дентатность - 1
5. Координационное число - 6
Комплексообразователи: Ag+, Cu2+, Hg2+, Zn2+, Ni2+, Fe3+, Pt4+ и др.
Лиганды: полярные молекулы H2O, NH3, CO и др.
анионы СN-, NO2-, Cl-, Br-, I-, OH- и др.
Координационные числа: обычно 4 или 6, реже 2, 3 и другие.
Номенклатура координационных соединений
Называют сначала анион (в именительном падеже), затем катион (в родительном падеже). Названия некоторых лигандов: NH3 - аммин, H2O - акво, CN- - циано, Cl- - хлоро, OH- - гидроксо. Названия координационных чисел: 2 - ди, 3 - три, 4 - тетра, 5 - пента, 6 - гекса. Называя комплексообразователь, надо указать его степень окисления.
Примеры: [Ag(NH3)2]Cl - хлорид диамминсеребра(I)
[Cu(NH3)4]SO4 - сульфат тетрааминмеди(II)
K3[Fe(CN)6] - гексацианоферрат(III) калия
K2[PtCl4] - тетрахлороплатинат(II) калия
[PtCl4(NH3)2] - диамминтетрахлороплатина(IV)
Химическая связь координационных соединений
Согласно теории валентных связей лиганды связаны с центральным атомом донорно-акцепторной связью. Центральный атом является акцептором, а лиганды - донорами. Эта донорно-акцепторная связь может сопровождаться другой (дативной) связью, в которой комплексообразователь является донором, лиганды акцепторами. Координационная связь может быть образована центральным атомом в его основном или возбужденных состояниях. Обычно, чтобы судить о состоянии центрального атома, нужно иметь дополнительную информацию о его магнитных свойствах.
При необходимости допускается использование внешних орбиталей соответствующей симметрии. Например, использование 4d-АО для комплексов 3d-металлов. Образующиеся при этом внешнеорбитальные, высокоспиновые комплексы, как правило, менее устойчивы по сравнению с образующимися с использованием лишь 3d-АО внутриорбитальными низкоспиновыми комплексами 3d-металлов.
Поскольку связи в комплексе одинаковы, а используемые орбитали центрального атома относятся к разным подуровням, то теория валентных связей предполагает гибридизацию орбиталей центрального атома. Расположение образующихся при этом гибридных орбиталей определяет геометрию комплексов.
Примеры определение геометрии и стабильности комплексов
Комплексный ион Ag(NH3)2+


 Молекула аммиака: ¯ NH3 - донор.
Молекула аммиака: ¯ NH3 - донор.
 Ион серебра - акцептор: Ag+ 4d105s05p0 .
Ион серебра - акцептор: Ag+ 4d105s05p0 .
Координационное число равно 2, значит sp-гибридизация:



























 ¯ ¯ ¯ ¯ ¯ s p p p ® ¯ ¯ ¯ ¯ ¯ sp sp
¯ ¯ ¯ ¯ ¯ s p p p ® ¯ ¯ ¯ ¯ ¯ sp sp
 |  |  |  |
Комплекс диамагнитный (все электроны спарены) и линейный - угол между связями 180о.
H3N® Ag+ NH3
Диамагнитный комплексный ион Fe(CN)64-


 Цианид ион - донор ¯ СºN-.
Цианид ион - донор ¯ СºN-.
 Ион железа Fe2+ - акцептор - имеет формулу 3d64s04p0. C учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d2sp3-гибридизацию:
Ион железа Fe2+ - акцептор - имеет формулу 3d64s04p0. C учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d2sp3-гибридизацию:






















 ¯ ¯ ¯ d d s p p p ®
¯ ¯ ¯ d d s p p p ®
 |  |  |  |
Комплекс диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние 4d-орбитали), октаэдрический (d2sp3-гибридизация).
Парамагнитный комплексный ион FeF63-
Фторид ион - донор.





















 Ион железа Fe3+ - акцептор - имеет формулу 3d54s04p0. C учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp3d2-гибридизацию:
Ион железа Fe3+ - акцептор - имеет формулу 3d54s04p0. C учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp3d2-гибридизацию:
s p p p d d ®
 |  |  |  |







 ®
®

Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4d-орбитали), октаэдрический (sp3d2-гибридизация).
Диссоциация координационных соединений
Координационные соединения в растворе полностью диссоциируют на ионы внутренней и внешней сфер.
K4[Fe(CN)6] ® 4K+ + Fe(CN)64- =1
[Ag(NH3)2]NO3 ® Ag(NH3)2+ + NO3- =1
Ионы внутренней сферы, то есть, комплексные ионы, диссоциируют на ионы металла и лиганды как слабые электролиты, по ступеням.
Ag(NH3)2+  Ag(NH3)+ + NH3 K1 =
Ag(NH3)+ + NH3 K1 = 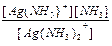 = 1,2´10-4
= 1,2´10-4
Ag(NH3)+  Ag+ + NH3 K2 =
Ag+ + NH3 K2 = 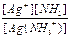 = 4,8´10-4
= 4,8´10-4
или суммарно имеем: 
Ag(NH3)2+  Ag+ + 2NH3 K1-2 = K1´ K2 =
Ag+ + 2NH3 K1-2 = K1´ K2 = 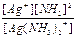 = 5,8´10-8
= 5,8´10-8
где К1, К2, K1-2 называются константами нестойкости и характеризуют диссоциацию комплексов. Чем меньше константа нестойкости, тем меньше диссоциирует комплекс, тем он устойчивее.
Пример. Найти концентрации [NH3], [Ag(NH3)+] и [Ag+] в 0,8М растворе [Ag(NH3)2]NO3.
Решение. Для первой стадии диссоциации Ag(NH3)2+ (см. выше) имеем: K1 = 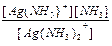 = 1,2´10-4.
= 1,2´10-4.
Поскольку комплексный ион мало диссоциирует, то можно пренебречь количеством диссоциировавших ионов по сравнению с недиссоциировавшими и записать [Ag(NH3)2+] = 0,8М. Пренебрегая диссоциацией по второй ступени, имеем [Ag(NH3)+] = [NH3].
Отсюда K1 = [NH3]2/0,8 = 1,2´10-4 и далее
[NH3] = [Ag(NH3)+] = 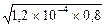 = 1´10-2М.
= 1´10-2М.
Для второй ступени диссоциации имеем:
K2 = 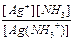 = 4,8´10-4 и поскольку [Ag(NH3)+] = [NH3], то
= 4,8´10-4 и поскольку [Ag(NH3)+] = [NH3], то
[Ag+] = 4,8´10-4М.
Увеличение концентрации лиганда уменьшает количество свободных ионов комплексообразователя в растворе. Это положение аналогично эффекту общего иона для растворов слабых электролитов и гетерогенных равновесий.
Пример. Найти концентрации [Ag(NH3)+] и [Ag+] в 0,8М растворе [Ag(NH3)2]NO3, содержащем в избытке 0,8М раствор [NH3].
Решение. Имеем: [NH3] = 0,8М и [Ag(NH3)2+] = 0,8М и далее K1 = 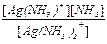 =
= 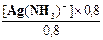 = 1,2´10-4
= 1,2´10-4
откуда [Ag(NH3)+] = 1,2´10-4М.
Также имеем K2 = 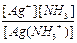 =
= 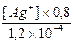
 = 4,8´10-4 откуда
= 4,8´10-4 откуда
[Ag+] = 7,2´10-8М
Таким образом, добавление избытка аммиака в соответствие с приведенным выше правилом уменьшило диссоциацию комплексного иона [Ag(NH3)2+]: концентрация в растворе [Ag(NH3)+] уменьшилась с 1.0´10-2М до 1,2´10-4М, а концентрация [Ag+] уменьшилась с 4,8´10-4М до7,2´10-8М.
Пример. Найти растворимость (в моль/л) хлорида серебра AgCl (Ks = 1,8´10-10) в 1М растворе NH3 (для Ag(NH3)2+ имеем
K1-2 = 5,8´10-8).
Решение. Имеем два равновесия:
AgCl  Ag+ + Cl- и Ag(NH3)2+
Ag+ + Cl- и Ag(NH3)2+  Ag+ + 2NH3
Ag+ + 2NH3
s s
Ионы Ag+ , образующиеся при растворении AgCl, будут практически полностью связаны в комплексный ион Ag(NH3)2+ в силу его малой диссоциации. Отсюда: s = [Cl-] = [Ag(NH3)2+].
Полагая, что [NH3] = 1М, определяем концентрацию свободных ионов серебра:
K1-2 = 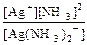 =
= 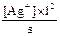 = 5,8´10-8 и [Ag+] = s´5,8´10-8.
= 5,8´10-8 и [Ag+] = s´5,8´10-8.
Подставляем найденное значение [Ag+] в выражение для Кs(AgCl):
Ks = [Ag+][Cl-] = s´5,8´10-8´s = 1,8´10-10 и определяем растворимость хлорида серебра в одномолярном растворе аммиака:
s2 = 1,8´10-10/5,8´10-8 = 0,31´10-2 и s = 0,056М.
Видно, что AgCl растворим в растворах аммиака.
Дата добавления: 2016-04-11; просмотров: 4596;
