Константа растворимости. Растворимость.
В системе, состоящей из раствора и осадка, идут два процесса - растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия.
Насыщенный раствор - это раствор, который находится в равновесии с осадком.
Применим закон действия масс к равновесию между осадком и раствором.
AgCl(тв.)  Ag+ + Cl-
Ag+ + Cl-
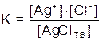 Поскольку [AgClтв] = const, имеем:
Поскольку [AgClтв] = const, имеем:
К×[AgClтв] = KSAgCl =[Ag+]×[Cl-] В общем виде имеем:
AmBn(тв.)  mA+n + nB-m и KS(AmBn) = [A+n]m×[B-m]n.
mA+n + nB-m и KS(AmBn) = [A+n]m×[B-m]n.
Константа растворимости KS (или произведение растворимости ПР) - произведение концентраций ионов в насыщенном растворе малорастворимого электролита - есть величина постоянная и зависит лишь от температуры.
Примеры величин KS для ряда солей:
KS(AgCl) = 1,6×10-10
KS(Ag2CrO4) = 1,1×10-12
KS(Ag2S) = 6×10-50.
Растворимость малорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые - s < 10-4 моль/л, среднерастворимые - 10-4 моль/л £ s £ 10-2 моль/л и хорошо растворимые s >10-2 моль/л.
Растворимость соединений связана с их константой растворимости. Для AgCl имеем:
AgCl(тв.)  Ag+ + Cl-
Ag+ + Cl-
s s s
Растворимость s - молярная концентрация AgCl в растворе:
s = [AgClр-р] = m/(M´V) [AgClр-р] = s = [Ag+] = [Cl-].
Отсюда KS AgCl = [Ag+]×[Cl-] = s2 и s= 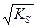 .
.
В общем виде для AmBn имеем: AmBn(тв.)  mA+n + nB-m
mA+n + nB-m
s ms ns
KS(AmBn) = [A+n]m×[B-m]n = (ms)m(ns)n = mmnnsm+n.
Пример. Найти растворимость AgCl (KS=1,6×10-10) и Ag2CrO4 (KS= 1,2×10-12).
Решение. AgCl  Ag+ + Cl- ,
Ag+ + Cl- ,
KS = s2, s = 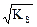 = 1,34×10-5 моль/л.
= 1,34×10-5 моль/л.
Ag2CrO4  2Ag+ + CrO42-
2Ag+ + CrO42-
s 2s s
KS = (2s)2×s = 4s3, s = 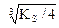 = 6,5×10-5 моль/л.
= 6,5×10-5 моль/л.
Хотя обычно растворимость тем меньше, чем меньше KS, в данном случае для соединений разных типов s(AgCl) < s(Ag2CrO4), хотя KS(AgCl) > KS(Ag2CrO4).
Условие осаждения и растворения осадка
Для равновесия между осадком и раствором - насыщенного раствора - имеем в случае AgCl:
AgCl  Ag+ + Cl- [Ag+]×[Cl-] = KS.
Ag+ + Cl- [Ag+]×[Cl-] = KS.
Условие осаждения записывается в виде: [Ag+]×[Cl-] > KS
В ходе осаждения концентрации ионов уменьшаются до установления равновесия.
Условие растворения осадка или существования насыщенного раствора записывается в виде: [Ag+]×[Cl-] < KS.
В ходе растворения осадка концентрация ионов увеличивается до установления равновесия.
Эффект общего иона
Добавление общего иона уменьшает растворимость малорастворимых соединений.
Пример. Найдем растворимость AgCl в 0,1 М растворе NaCl.
Решение. AgCl  Ag+ + Cl-
Ag+ + Cl-
s s s+0,1»0,1
KS AgCl = [Ag+]×[Cl-] = s × 0,1 = 1,6×10-10, s = 1,6×10-9 моль/л.
Растворимость AgCl в воде (см. выше) равна 1,34×10-5 моль/л, растворимость AgCl в 0,1М NaCl - 1,6×10-9 моль/л, т.е. в 104 раз меньше.
Солевой эффект
Увеличение ионной силы раствора увеличивает растворимость малорастворимых соединений.
Поскольку концентрации ионов, образующихся при диссоциации малорастворимых соединений, а также ионная сила получаемых растворов малы, то оказывается возможным использовать в выражениях KS концентрации ионов, а не их активности. В тех случаях, когда в растворе присутствуют сильные электролиты, обусловливающие большую ионную силу раствора, необходимо в выражении для KS подставлять активность ионов.
Определим растворимость AgCl в 0,1 М NaCl с учетом ионной силы раствора
AgCl  Ag+ + Cl-
Ag+ + Cl-
s s s+0,1»0,1
Для 0,1М NaCl m = 0,1 и fAg+ = fCl- = 0,78.
KS = aAg+×aCl- = fAg+×[Ag+]×fCl-×[Cl-] = 0,78×s×0,78×0,1 = 1,6×10-10,
s = 1,6×10-9/(0,78)2 = 2,6×10-9 M, т. е. в 1,64 раза больше, чем без учета ионной силы раствора. Солевой эффект значительно меньше эффекта одноименного иона.
Пример. Растворимость Mg(OH)2 равна 0,012 г/л. Найти KS.
Решение. М(Mg(OH)2) = 58 г/моль, s = 0,12г/л / 58г/моль =
= 2,07×10-4М.
Mg(OH)2  Mg2+ + 2OH-
Mg2+ + 2OH-
KS = [Mg2+]×[OH-]2 = s×(2s)2 = 4s3 = 4×(2,07×10-4)3 = 3,6×10-11.
Пример. Выпадает ли осадок PbCl2 при смешивании равных объемов растворов 0,1M Pb(NO3)2 и 0,1M NaCl, если KS(PbCl2) =
= 1,6×10-5.
Решение. После смешивания растворов концентрации ионов уменьшатся в два раза, т.е. имеем: [Pb2+] = [Na+] = [Cl-] = 0,05M, а [NO3-] = 0,1 M. Находим ионную силу раствора:
m = 1/2×(0,05×22 + 0,1×12 + 0,05×12 + 0,05×12) = 0,2.
Находим коэффициенты активности: fPb2+ = 0,24 и fCl- = 0,70.
Имея для PbCl2  Pb+2 + 2Cl-
Pb+2 + 2Cl-
KS PbCl2 = aPb2+×aCl-2, вычисляем величину aPb2+×aCl-2 для нашего раствора:
aPb2+×aCl-2 = fPb2+×[Pb2+]×(fCl-×[Cl-])2 = 0,24×0,05×0,702×0,052 = 1,47×10-5 , что меньше, чем ПРPbCl2 (1,6×10-5), поэтому осадка не образуется.
Дата добавления: 2016-04-11; просмотров: 6473;
