Ионное произведение воды. Водородный показатель.
Вода - слабый электролит - диссоциирует, образуя ионы H+ и OH-. Эти ионы гидратированы, то есть, соединены с несколькими молекулами воды, но для простоты мы записывали их в негидратированной форме
H2O  H+ + OH-.
H+ + OH-.
Применяя к этому равновесию закон действия масс, имеем:
K = 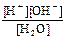 = 1,8×10-16 (22°С)
= 1,8×10-16 (22°С)
Концентрацию молекул воды [H2O], то есть число моль в 1 л воды можно считать постоянной и равной [H2O] = 1000 г/л : 18 г/моль = 55,5 моль/л. Получаем
К´[H2O] = К(H2O) = [H+]×[OH-] = 10-14 (22°С)
Произведение концентраций [H+] и [OH-], то есть ионное произведение воды, есть величина постоянная и равная 10-14 при 22°С: [H+]×[OH-] = 10-14
Ионное произведение воды увеличивается с увеличением температуры
| t°С | |||||
| K(H2O) | 0,4×10-14 | 1,0×10-14 | 1,9×10-14 | 5,6×10-14 | 74×10-14 |
Соотношение между количеством ионов [H+] и [OH-] определяет характер среды:
[H+] =10-7= [OH-] - нейтральная среда
[H+] >10-7> [OH-] - кислая среда
[H+] <10-7< [OH-] - щелочная среда.
Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода рН = - lg[H+].
Аналогично рOН = - lg[OH-].
Логарифмируя ионное произведение воды, получаем
pH + pOH = 14
Примеры. Если [H+] = 10-2M, то рН = 2, а [ОH-]= 10-12M.
Если [ОH-] = 10-4M, то [H+]= 10-10M, а рН = 10.
Если рН = 8, то [H+]= 10-8M, а [ОH-] = 10-6M
Если рОН = 5, то рН = 9, а [H+]= 10-9M.
Величина рН характеризует реакцию среды:
рН = 7 нейтральная среда
рН < 7 кислая среда
рН > 7 щелочная среда.
рН раствора можно определить с помощью индикаторов (лакмуса, фенолфталеина., метилоранжа и др.), универсальной индикаторной бумаги или с помощью рН-метра.
Индикатор меняет свою окраску в зависимости от рН раствора в определенном интервале рН: метилоранж в области рН=3,1-4,4; лакмус при рН=5,0-8,0; фенолфталеин в пределах рН=8,0-10,0. Индикатор - это обычно малодиссоциированная кислота или основание, имеющие в нейтральных и ионных формах разные окраски. Так например, лакмус НА - красный, а его анион А- - синий:
НА  Н+ + А-
Н+ + А-
красный синий
В кислой среде с увеличением [Н+] равновесие сдвигается влево, индикатор имеет красный цвет. В щелочной среде, с уменьшением [Н+] равновесие сдвигается вправо, и индикатор имеет синий цвет. В области перехода в интервале рН от 5,0 до 8,0 существуют обе формы, и индикатор имеет фиолетовый цвет.
Пример 1. Найти рН 0,01 М раствора NaOH (a=1)
Решение. NaOH  Na+ + OH- a=1
Na+ + OH- a=1
[OH-] = [NaOH] = 10-2 M, рОН=2, рН=12.
Пример 2. Найти рН 0,1 М раствора NН4OH (К=1,8×10-5)
Решение. NH4OH  NH4+ + OH-
NH4+ + OH-
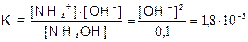
Так как [NH4OH] » C(NH4OH), а [OH-]=[NH4+], имеем:
[OH-] = 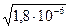 = 1,34×10-3 ; pOH = 2,87, pH = 11,13.
= 1,34×10-3 ; pOH = 2,87, pH = 11,13.
Пример 3. 0,1 М раствор СН3СООН имеет рН = 3. Найти степень диссоциации .
Решение. СH3СОOH  СH3СОО- + H+
СH3СОО- + H+
С-Сa Сa Сa
Отсюда [H+] = Сa и a = 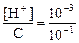 = 1×10-2, так как при рН=3 [H+]=10-3.
= 1×10-2, так как при рН=3 [H+]=10-3.
Пример 4. Раствор НСООН (К=1,8×10-4) имеет рН=1,87. Найти концентрацию кислоты С.
Решение. НСОOH  НСОО- + H+
НСОО- + H+
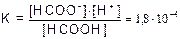 , так как [H+] = [HCOO-] имеем [HCOOH] =
, так как [H+] = [HCOO-] имеем [HCOOH] = 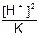 , так как рН=1,87, то [H+]= 1,34×10-2.
, так как рН=1,87, то [H+]= 1,34×10-2.
[HCOOH] = 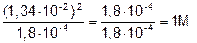 .
.
Буферные растворы.
Буферные растворы - это растворы, имеющие постоянную определенную концентрацию ионов водорода. рН этих растворов не меняется при разбавлении и мало меняется при добавлении небольших количеств кислот и щелочей. Буферные растворы состоят из растворов слабой кислоты и ее соли с сильным основанием или из раствора слабого основания и его соли с сильной кислотой. Рассмотрим оба возможных случая.
I. Раствор слабой кислоты НА, концентрация - Скисл, и ее соли, сильного основания ВА, концентрация Ссоли. Например, ацетатный буфер - раствор уксусной кислоты и ацетата натрия
CH3COOH + CH3COONa.
В общем случае имеем смесь: НА + ВА
HА  Н+ + А- (a<<1)
Н+ + А- (a<<1)
ВА  В+ + А- (a=1).
В+ + А- (a=1).
Поскольку НА - слабый, а ВА - сильный электролит, имеем [HA] = Cкисл. и [A-] = Ссоли.
Подставим найденные значения и выражение для константы диссоциации кислоты НА:
Ккисл = 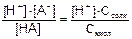 [H+] = Ккисл×Скисл /Ссоли.
[H+] = Ккисл×Скисл /Ссоли.
рН = рКкисл + lg(Ссоли/Скисл).
Например, в случае ацетатного буферного раствора
(рКСН3СООН = 4,75) его рН будет равна 4,75, если Ссоли = Скислоты. Очевидно, что при разбавлении концентрации соли и кислоты будут уменьшаться одинаково, а соотношение Ссоли / Скислоты и рН не будут меняться.
II. Раствор слабого основания ВОН, концентрация - Сосн и его соли сильной кислоты ВА, концентрации Ссоли. Например, аммиачный буфер - раствор гидроксида аммония и хлорида аммония NH4OH + NH4Cl. В общем случае имеем: ВОН + ВА:
ВОH  В+ + ОН- (a<<1)
В+ + ОН- (a<<1)
ВА  В+ + А- (a=1).
В+ + А- (a=1).
Поскольку ВОН - слабый, а ВА - сильный электролит, имеем [ВОH] = Cосн. и [В+] = Ссоли. Подставим эти значения в выражения для константы диссоциации основания ВОН.
Косн =  [OH-] = Косн×Сосн /Ссоли.
[OH-] = Косн×Сосн /Ссоли.
рОН = рКосн + lg(Ссоли/Сосн), рН = 14 - рКосн + lg(Ссоли/Сосн).
Например, в случае аммиачного буферного раствора
рК (NH4OH) = 4,75 и Сосн = Ссоли, имеем рН = 14 - 4,75 = 9,25.
Из приведенной формулы видно, что в этом случае рН не зависит от разбавления, так как отношение Ссоли /Скисл остается при этом неизменным.
Задача. Как изменится рН при добавлении 1 мл ! М раствора HСl: а) к 100 мл Н2О; б) к 100 мл буферной смеси, содержащей 0,1 М СН3СООН и 0,1 М СН3СООNа. Изменением объема можно пренебречь.
Решение. а) рН воды до прибавления кислоты равен 7. При смешении 1 мл 1М раствора HCl и 100 мл воды объем увеличивается в 100 раз, а концентрация кислоты будет в 100 раз меньше, т.е. [HCl]=10-2М. Поскольку HCl - сильная кислота, то [H+]=10-2М и рН = 2. Таким образом, при добавлении 1 мл 1М раствора HСl к 100 мл воды рН изменяется с 7 до 2, т.е. на 5 единиц.
б) рН буферного раствора до прибавления кислоты равен 4,75. При добавлении раствора HCl к буферной смеси пройдет реакция: HCl + CH3COONa ® CH3COOH + NaCl,
в результате которой концентрация CH3COONa уменьшается, а концентрация СН3СООН - увеличивается. Найдем число моль (n) веществ до реакции (n = CM × V).
n (HCl) = 1 моль/л × 0,001 л = 0,001 моль.
n(CH3COOH) = n(CH3COONa) = 0,1 моль/л × 0,1 = 0,01 моль.
После реакции n(HCl) = 0, n(CH3COOH) = 0,01 + 0,001 = 0,011 моль, n(CH3COONa) = 0,01 - 0,001 = 0,009 моль.
Считая объем неизменным и равным V = 0,1 л, имеем:
C(CH3COOH) = 0,11 М и С(CH3COONa) = 0,09 М. Значения концентраций подставляем в формулу расчета рН:
рН = рКкисл + lg(Ссоли/Скисл) = 4,75 + lg(0,09/0,11) = 4,75-0,09 = 4,66. Таким образом, при добавлении 1 мл 1М раствора кислоты к 100 мл буферного раствора рН изменяется на 4,75 - 4,66 = 0,09.
Малое изменение рН при добавлении соляной кислоты к ацетатному буферу обусловлено превращением сильной кислоты (HCl) в слабую кислоту (СН3СООН). При добавлении щелочи, например NaOH, к ацетатному буферу происходит реакция щелочи с уксусной кислотой с образованием ацетата натрия. Если количество добавляемой щелочи мало по сравнению с количеством буфера, то изменение концентрации кислоты и соли в буфере будут невелики, и рН раствора будет меняться незначительно.
Гидролиз солей
Гидролиз солей - это взаимодействие ионов соли с водой с образованием слабого электролита.
Степень гидролиза h - отношение числа гидролизованных молекул к общему числу растворенных молекул. Например:
CH3COONa + H2O  CH3COOH + NaOH
CH3COOH + NaOH
CH3COO- + Na+ +H2O  CH3COOH + Na+ + OH-
CH3COOH + Na+ + OH-
CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
С- h Сh Сh
K= 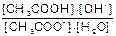 - константа равновесия;
- константа равновесия;
Поскольку [H2O] = 55,5 г/моль - постоянная величина, то имеем K´[H2O] = Кг , где Кг - константа гидролиза
Кг = 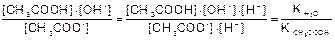
Кг = 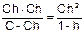 . Для многих солей h<<1 и 1 -h » 1.
. Для многих солей h<<1 и 1 -h » 1.
Отсюда Кг = Сh2 и h = 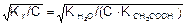 .
.
Из полученного выражения следует, что степень гидролиза h (то есть гидролиз) увеличивается:
а) с увеличением температуры, так как тогда увеличивается 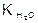 ;
;
б) с уменьшением 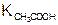 , чем слабее кислота, образующая соль, тем больше гидролиз;
, чем слабее кислота, образующая соль, тем больше гидролиз;
в) с разбавлением, чем меньше С, тем больше гидролиз.
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и сильной кислотой:
KNO3 + H2O ¹
K+ + NO3- + H2O ¹ нет гидролиза рН = 7.
II. Соль образована слабым основанием и сильной кислотой:
AlCl3 + H2O  (AlOH)Cl2 + HCl
(AlOH)Cl2 + HCl
Al3+ + 3Cl- + H2O  AlOH2+ + 2Cl- +H+ + 3Cl-
AlOH2+ + 2Cl- +H+ + 3Cl-
Al3+ H2O  AlOH2+ + H+ pH < 7.
AlOH2+ + H+ pH < 7.
По второй ступени гидролиз идет незначительно, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и слабой кислотой:
Na2CO3 + H2O  NaHCO3 + NaOH
NaHCO3 + NaOH
2Na+ + CO32- + H2O  2Na+ + HCO3- + OH-
2Na+ + HCO3- + OH-
CO32- + H2O  HCO3- + OH- pH > 7.
HCO3- + OH- pH > 7.
По второй ступени гидролиз практически не идет.
IV. Соль образована слабым основанием и слабой кислотой:
CH3COONH4 + H2O  CH3COOH + NH4OH
CH3COOH + NH4OH
CH3COO- + NH4+ +H2O  CH3COOH + NH4OH
CH3COOH + NH4OH
Для солей подобного типа рН вычисляется следующим способом:
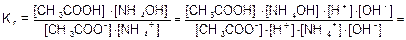
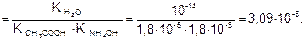
Идет частичный гидролиз, так как Кг << 1.
Степень гидролиза равна: h = 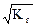 = 5,56´10-3.
= 5,56´10-3.
Концентрация ионов водорода равна: [H+] = 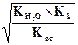 = 10-7M.
= 10-7M.
В ряде случаев, когда соль образована очень слабым основаниями и кислотами идет полный гидролиз.
Al2S3 + 6H2O ® 2Al(OH)3¯ + 3H2S
Возможность полного гидролиза следует учитывать в обменных реакциях.
Al(SO4)3 + 3Na2CO3 + 3H2O ® 2Al(OH)3¯ + 3Na2SO4 + 3CO2
Дата добавления: 2016-04-11; просмотров: 3812;
