Диссоциация слабых электролитов
Применим закон действия масс к равновесию между ионами и молекулами в растворе слабого электролита, например, уксусной кислоты:
CH3COOH  CH3COO- + H+
CH3COO- + H+ 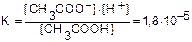
или синильной кислоты:
HCN  H+ + CN-
H+ + CN- 
Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов, чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее. Так, например, поскольку КHCN =6,2×10-10<KCH3COOH = 1,8×10-5, то синильная кислота хуже диссоциирует и слабее, чем уксусная кислота.
Многоосновные кислоты диссоциируют ступенчато:
H3PO4  H+ + H2PO4-
H+ + H2PO4- 
H2PO4-  H+ + HPO42-
H+ + HPO42- 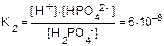
HPO42-  H+ + PO43-
H+ + PO43- 
Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
H3PO4  3H+ + PO43-
3H+ + PO43- 
Закон разбавления Оствальда. При диссоциации слабого электролита, например, CH3COOH, молярная концентрация которого равна С, начальные и равновесные концентрации молекул и ионов равны:
CH3COOH  CH3COO- + H+
CH3COO- + H+
Снач С 0 0
Сравн С-C C C
где - степень диссоциации.

Поскольку для слабых электролитов a<<1 и 1 - a » 1, имеем K=C×a2 или =  .
.
Закон разбавления Оствальда: степень диссоциации слабого электролита увеличивается при уменьшении его концентрации, то есть при разбавлении.
Влияние общего иона на диссоциацию слабого электролита. Добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH
CH3COOH  CH3COO- + H+ <<1
CH3COO- + H+ <<1
сильного электролита, содержащего общий с CH3COOH ион, то есть ацетат-ион, например, CH3COONa
CH3COONa  CH3COO- + Na+ = 1
CH3COO- + Na+ = 1
концентрация ацетат иона увеличивается, и равновесие диссоциации CH3COOH сдвигается влево, то есть диссоциация уменьшается.
Пример. Найти [H+] в 0,1 М растворе CH3COOH K=1,8×10-5.
Решение. Для CH3COOH  CH3COO- + H+
CH3COO- + H+
имеем  Поскольку CH3COOH - слабый электролит, то [CH3COOH] = С = 0,1 М, кроме того [H+] = [CH3COO-]. Отсюда
Поскольку CH3COOH - слабый электролит, то [CH3COOH] = С = 0,1 М, кроме того [H+] = [CH3COO-]. Отсюда 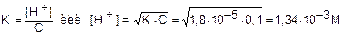 .
.
Пример. Найти [H+] в растворе 0,1 М CH3COOH (K=1,8×10-5) и 0,1 М CH3COONa (a=1).
Решение. Имеем CH3COOH  CH3COO- + H+ (<<1)
CH3COO- + H+ (<<1)


и CH3COONa  CH3COO- + Na+ = 1
CH3COO- + Na+ = 1
Учитывая, что CH3COOH - слабый электролит и пренебрегая числом диссоциированных молекул, полагаем
[CH3COOH] = C(CH3COOH)=0,1 М. Поскольку CH3COONa диссоциирован полностью и пренебрегая количеством ионов CH3COO-, образовавшихся при диссоциации CH3COOH, получаем
[CH3COO-]=C(CH3COONa)=0,1 М. Отсюда имеем:  .
.
Видно, что при добавлении раствора CH3COONa к раствору CH3COOH концентрация ионов водорода уменьшилась в 1,34×10-3 / 1,8×10-5 = 74,4 раза.
Дата добавления: 2016-04-11; просмотров: 6479;
