Растворимость. Способы выражения концентрации
При изучении данной темы необходимо обратить внимание на следующие основные понятия теории растворов.
Растворы представляют собой дисперсные системы, в которых частицы одного вещества равномерно распределены в другой. В дисперсных системах различают дисперсионную среду и дисперсную фазу (измельченное в дисперсионной среде вещество), которые могут существовать в трех агрегатных состояниях (Г - газ, Ж - жидкость, Т - твердое вещество). Итак, возможны 9 типов дисперсных систем, но к растворам чаще относят системы Г + Ж, Ж + Ж, Т + Ж (первая буква - дисперсная фаза, вторая - дисперсионная среда).
В зависимости от размеров частиц дисперсной фазы различают истинные растворы (частицы с размером 0,1-1 нм), коллоидные системы (1-100 нм) и грубодисперсные системы (размер частиц более 100 нм). К грубодисперсным системам относятся суспензии, эмульсии, пены. Следует обратить внимание на отличительные свойства истинных растворов от свойств других систем.
Истинные растворы - это гомогенные термодинамически устойчивые дисперсные системы, состоящие из двух и более компонентов, способных существовать независимо друг от друга, соотношение между которыми может варьировать в широких пределах. Размер частиц дисперсной фазы в них равен размерам молекул или ионов.
Необходимо ознакомиться с механизмом и термодинамикой процесса растворения, обратив внимание, что интегральная теплота растворения (ΔНр.) отражает влияние двух факторов - ΔН фазового перехода вещества дисперсной фазы (или энергию ее кристаллической решетки) и ΔН сольватации:
∆Нр. =ΔНф.п. + ∆Нсольв.
Итак, при растворении веществ всегда наблюдается выделение или поглощение теплоты. Энтропия систем Ж + Ж и Т + Ж растет (ΔS> 0), так как вещества с более упорядоченного состояния переходят в менее упорядочен. При растворении газов энтропия системы Г + Ж уменьшается (ΔS<0). Но во всех случаях изобарно-изотермический потенциал всегда уменьшается (ΔGp<0), то есть, растворение - самопроизвольный процесс.
Следует обратить внимание на растворимость органических и неорганических веществ в воде и других растворителях (спиртах, кетонах, эфирах, углеводородах и т.д.), пользуясь известным правилом: «подобное растворяется в подобном». Например, полярные растворители, вода, ацетон, этанол, диметилформамид, ацетонитрил смешиваются и растворяются друг в друге в неограниченном соотношении. Практически отсутствует взаимная растворимость в системах с противоположными свойствами компонентов: вода-октан, вода-бензол. При растворении газов в жидкости возможно образование двух систем: с наличием химического взаимодействия и с ее отсутствием. В случае наличия химического взаимодействия (например, растворение NH3, НCl, HBr в воде) растворимость газов значительно выше, чем при ее отсутствии (O2, N2, CO, инертные газы). В последнем случае зависимость растворимости газов от давления выражается законом Генри-Дальтона (1802): при постоянной температуре растворимость газа в жидкости (С) прямо пропорциональна его парциальному давлению (Р):
С = k·Р,
где k - коэффициент пропорциональности.
Растворы с большой концентрацией растворенного вещества называются концентрированными, а с малой - разбавленными. Когда раствор находится в динамическом равновесии с одним из компонентов раствора, он называется насыщенным, а его концентрация соответствует растворимости этого компонента. Под растворимостью обычно понимают массу растворенного вещества в 100 г растворителя в насыщенном растворе.
В практике насыщенными растворами пользуются редко, характеризовать концентрацию раствора по величине растворимости неудобно. В связи с этим для количественной характеристики растворов применяют другие способы выражения концентрации. Они достаточно подробно рассмотрены в задачнике Н.Л. Глинки. Стоит запомнить основные пять способов:
1. Доли - мольная (объемная, массовая) - отношение количества молей (объема, массы) одного из веществ к сумме количества молей (объемов, масс) всех веществ смеси:
мольная - хА = 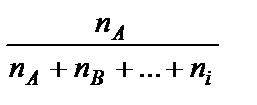 ;
;
объемная - jА= 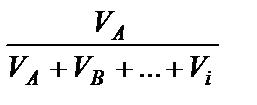 ;
;
массовая - 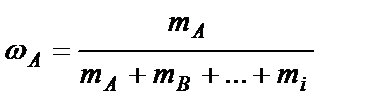
Сумма долей смеси равна единице.
2. Моляльность - число молей растворенного вещества в 1000 г растворителя;
Сm = 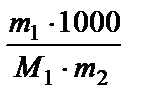 (моль/кг), где m1, m2 - массы растворенного вещества и растворителя, г.
(моль/кг), где m1, m2 - массы растворенного вещества и растворителя, г.
3. Молярность - число молей растворенного вещества в 1 л раствора;
СМ = 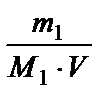 (моль / л), где V - объем раствора, л.
(моль / л), где V - объем раствора, л.
4. Нормальность (молярная концентрация эквивалента) - число молей эквивалентов растворенного вещества в 1 л раствора;
Сн = 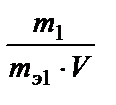 (моль-экв/л); mэ1 - эквивалентная масса растворенного вещества.
(моль-экв/л); mэ1 - эквивалентная масса растворенного вещества.
5. Титр - количество граммов растворенного вещества, содержащихся в 1 мл раствора; Т = 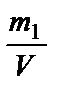 (г / мл).
(г / мл).
При определении концентрации неизвестного раствора методом титрования используют закон эквивалентов, для растворов имеет вид:
Сн1×V1 =Сн2 ×V2.
При растворении в воде малорастворимых неорганических веществ (например, BaSO4, Ag2ClO4, Fe(OH)3, AgCl) большая часть вещества остается в осадке, между которым и насыщенным раствором устанавливается равновесие:
BaSO4 = [BaSO4] =Ва2+ + SO4²ˉ,
константа которого имеет выражение: К = [ Ва2+] [SО42ˉ] / [ВаSО4 тв. ]. Поскольку в раствор переходит незначительная часть сульфата бария, то можно констатировать, что количество твердой фазы при постоянной температуре практически не меняется. Итак, [Ва2+] [SО42ˉ] = К·[ВаSО4 тв.] = const = ПР.
Произведение растворимости (ПР) - показатель растворимости: чем меньше величина ПР, тем меньше вещества способно переходить в раствор. Растворимость малорастворимого вещества легко найти, если воспользоваться табличными данными произведения растворимости.
Например, растворимость ВаSО4 находят из таких соотношений:
[BaSO4] = [ Ва2+] = [SО42ˉ] = √ПР = √1,1·10-10 = 1,08·10-5 моль/л = 1,08·MBaSO4·10-5 ≈ 2,5·10-3 г/л. Аналогично, растворимость Ag2CrO4 равна:
[Ag2CrO4] = [ CrO42ˉ] = 3√ПР/4 = 3√4.05·10-12 ≈ 1·10-4 моль/л
В насыщенном растворе малорастворимого соединения KmAn устанавливается равновесие:
KmAn = mKn+ + nAm-
твердая фаза насыщенный раствор
То есть, ПР = [Kn+]m · [Am-]n. В общем виде растворимость KmAn в моль / л определяют по формуле:
P KmAn = m+n√ПР(KmAn)/(mm · nn) .
Добавление одноименного иона в систему «осадок-раствор» будет смещать равновесие в сторону выпадения осадка.
Задача 1. Определить молярную, нормальную концентрации и титр 40%-ного раствора Н2SO4 (ρ = 1,31 г / см3).
Решение. По формуле 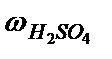 =
= 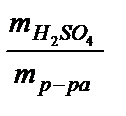 находим массу растворенного вещества Н2SO4:
находим массу растворенного вещества Н2SO4:
m 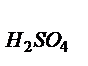 =
= 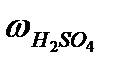 ×mр-ра. =
×mр-ра. = 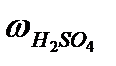 ×
× 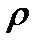 ×V = 0,40×1,31г/мл×1000 мл = 524 (г), (где V = 1000 мл).
×V = 0,40×1,31г/мл×1000 мл = 524 (г), (где V = 1000 мл).
Находим молярную концентрацию: СМ = 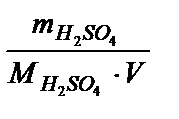 =
= 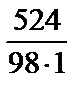 = 5,35 (моль/л).
= 5,35 (моль/л).
Находим нормальную концентрацию: Сн = 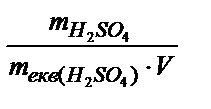 =
= 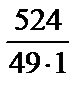 = 10,7 (моль-экв / л).
= 10,7 (моль-экв / л).
Находим титр: Т = 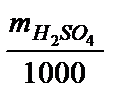 =
= 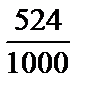 = 0,524 (г/мл).
= 0,524 (г/мл).
Задача 2. Сколько граммов Na2CO3 необходимо для полного взаимодействия его со 100 мл 4 н. раствора НСl?
Решение. Задача решается по закону эквивалентов.
Из формулы Сн = 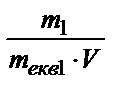 следует:
следует: 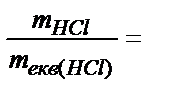 VHCl×Cн(НCl) . Комбинированное выражение закона эквивалентов имеет вид для данного случая:
VHCl×Cн(НCl) . Комбинированное выражение закона эквивалентов имеет вид для данного случая: 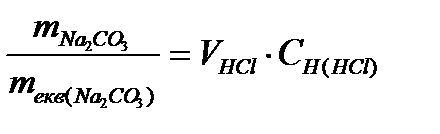 Þ mNa
Þ mNa  СО
СО  = mэкв(Na
= mэкв(Na 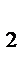 СО
СО 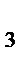 )×VHCl×Cн(HCl) =53×0,1×4 = 21,2 (г).
)×VHCl×Cн(HCl) =53×0,1×4 = 21,2 (г).
Задача 3. В лаборатории есть раствор с процентной концентрацией хлорида натрия 20 и 10%. Определите массу каждого из растворов, которые необходимо смешать для приготовления 300 г раствора с процентной концентрацией 12%.
Решение. При выполнении экспериментальных работ часто приходится рассчитывать концентрацию раствора, образующегося при разбавлении, концентрировании или смешивании двух растворов. В этом случае удобно использовать «правило креста»:

где С1 и С2 - концентрации исходных, С3 - конечных растворов, причем С1> C3, а С3> C2. Для массовых значений выражения концентрации находим: 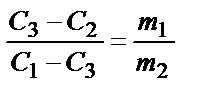 ; для объемных:
; для объемных: 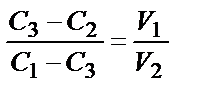 . В случае разбавления раствора чистым растворителем С2 принимается равным нулю. Эту задачу можно решить с помощью "правила креста". Составляем диаграмму:
. В случае разбавления раствора чистым растворителем С2 принимается равным нулю. Эту задачу можно решить с помощью "правила креста". Составляем диаграмму:

где х1 и х2 - соответствующие массовые части растворов. Как следует из этой диаграммы, для приготовления необходимого раствора следует взять 2 массовые части 20% и 8 массовых частей 10% растворов.
Рассчитаем массы каждого из растворов по формулам:
m1 = = 60 (г); m2 = 240 (г) или m2 = 300 - m1 = 300-60 = 240 (г).
Задача 4: Определить растворимость Ca3(PO4)2 в моль / л и в г / л.
Решение: В водном растворе Ca3(PO4)2 диссоциирует по уравнению:
Ca3(PO4)2 = 3 Ca 2+ + 2PO43-
То есть, трем катионам Ca2+ соответствуют два аниона PO43-. Растворимость фосфата кальция определяют с учетом значения произведения растворимости:
ПРCa3(PO4)2 = [Ca 2+ ]3 · [PO43-]2 = 3 ·10-33
Р Ca3(PO4)2 = 3+2√ПРCa3(PO4)2/33· 22 = 5√3 · 10-33/108 ≈ 1,2 · 10-7 моль/л
Молярная масса Ca3(PO4)2 равна 310 г / моль. Итак, растворимость Ca3(PO4)2 = 1,2 · 10-7 · 310 = 3,72 · 10-5 г / л.
Дата добавления: 2016-02-27; просмотров: 1788;
