Приготовление раствора щелочи
а) Приготовление раствора щелочи указанной процентной концентрации в соответствии с вариантом задания (табл. 5).
Рассчитывают, какую массу гранулированной щелочи необходимо взять для приготовления 100 г раствора с указанной в задании массовой долей. Взвешивают рассчитанное количество щелочи на техно-химических весах с точностью до 0,1 г и переносят в колбу на 100 мл. Отмеряют цилиндром необходимое количество воды и приливают ее к щелочи. После охлаждения раствора до комнатной температуры измеряют его плотность ареометром и сравнивают полученную величину с табличными данными.
б) Приготовление раствора щелочи указанной нормальной концентрации в соответствии с вариантом задания (табл. 5), используя раствор, полученный в опыте а.
Рассчитывают, какой объем исходного раствора необходимо для приготовления 50 мл раствора с концентрацией Сн.:
Vр-ра = mр-ра / ρр-ра ,
mр-ра = mщел / ω, поэтому: Vр-ра = 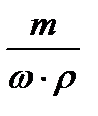 . Массу растворенного вещества mщел находят: mщел = Сн·mэкв (щелочи) ·V, откуда следует, что объем исходного раствора составляет:
. Массу растворенного вещества mщел находят: mщел = Сн·mэкв (щелочи) ·V, откуда следует, что объем исходного раствора составляет:
Vр-ра = 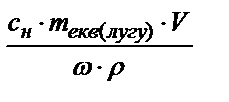 .
.
Отбирают пипеткой рассчитанный объем раствора и переносят в мерную колбу на 50 мл. С помощью пипетки добавляют дистиллированной воды до соответствующей метки, ориентируясь на нижней мениск;
в) проверка нормальности приготовленного в опыте раствора методом прямого титрования.
Если точно измерить объемы растворов химических веществ, вступивших в реакцию (в данном случае кислоты и щелочи), и знать концентрацию одного раствора (кислоты), то легко вычислить концентрацию другого (щелочи). Процесс постепенного добавления раствора с известной концентрацией вещества (титрованного раствора) к точно измеренному объему анализируемого раствора называется титрованием.
С помощью пипетки отбирают 3 пробы анализируемого раствора щелочи по 10 мл и добавляют в каждую пробу 3-4 капли фенолфталеина. Проводят ориентировочный опыт: небольшими порциями добавляют кислоту из бюретки в колбу со щелочью до исчезновения окраски фенолфталеина. Раствор в колбе перемешивают во время опыта легкими круговыми движениями колбы. Делают отсчет объема потраченной кислоты с точностью до десятых долей мл. Исходя из закона эквивалентов: Сн к×Vк = Cн щел×Vщел, рассчитывают нормальную концентрацию приготовленного раствора.
Повторяют титрование еще два раза, уточняя концентрацию раствора.
Дата добавления: 2016-02-27; просмотров: 2303;
