Влияние катализатора на скорость реакции
В две пробирки вносят по 1 - 2 мл 0,5 н. раствора калий роданида KSCN и по 2 - 3 капли 0,5 н. раствора железа (3+) хлорида. Что наблюдаете?
В одну из пробирок добавляют 2 - 3 капли 1 н. раствора сульфата меди CuSO4. Затем в обе пробирки вносят небольшое количество тиосульфата натрия. Наблюдают различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (3+) в железо (2+):
2Fe(SCN)3 + 2Na2S2O3 ® Na2S4O6 + 2Fe(SCN)2 +2NaSCN.
Отмечают все наблюдения и записывают уравнения реакций:
- взаимодействия хлорида железа(3+) с роданидом калия с образованием Fe(SCN)3;
- восстановление железа(3+) в железо(2+) тиосульфатом натрия. Какой цвет имеет раствор Fe(SCN)2?
В заключении укажите: что является катализатором в данном опыте?
Опыт 4. Изучение скорости разложения мурексида в кислой среде методом фотоколориметрии
В кислой среде мурексид (аммонийная соль пурпуровой кислоты) разлагается на урамил и аллоксан:
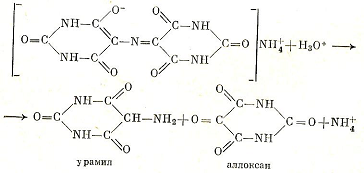
Скорость этой реакции описывается кинетическим уравнением реакции первого порядка. Константа скорости k пропорциональна концентрации ионов водорода:
k = k0 · сН+
где k0 – коэффициент пропорциональности, численно равный константе скорости реакции при концентрации ионов водорода сН+ = 1 моль/л. Реакция разложения мурексида в кислой среде сопровождается изменением окраски от фиолетовой до бесцветной. Поэтому для изучения кинетики реакции используются спектрофотометрический метод.
Порядок выполнения работы. Измерения оптической плотности реакционной смеси производят на фотоэлектроколориметре. Светофильтр – зелёный (λ = 520 нм). Длина кюветы l = 10 мм.
Реакционную смесь готовят в сосуде Оствальда. В одну из частей сосуда наливают 5 мл раствора мурексида, имеющего оптическую плотность D = 0,8 – 1,0 при длине кюветы 10 мм, а в другую – 5 мл раствора кислоты, указанной преподавателем. Сосуд с раствором помещают в термостат. Через 10-15 минут сосуд вынимают из термостата и встряхивают. Реакционную смесь быстро наливают в кювету и производят измерения оптической плотности с помощью фотоэлектроколориметра через определённые промежутки времени. Результаты кинетических измерений заносят в таблицу 6. Значение константы скорости рассчитывают по формуле:
k = 2,3 / τ · lg (D0/D),
где D0 и D – оптические плотности реакционной смеси при τ = 0 и в момент времени τ.
Таблица 6
Результаты кинетических измерений
| Время реакции τ, с | Оптическая плотность D | k, c-1 |
При исследовании влияния концентрации ионов водорода на скорость реакции можно использовать растворы кислот HCl или H2SO4 с концентрациями 0,001 – 0,005 г-экв/л.
Если же целью работы является определение константы диссоциации слабой кислоты, то производят измерения констант скорости реакции разложения мурексида в присутствии 0,005 н. HClи в присутствии слабой кислоты. На основании изучения скорости реакции в 0,005 н. HClопределяют коэффициент пропорциональности k0, используя формулу k = k0 · сН+. Изучение кинетики разложения мурексида в растворе слабой кислоты позволяет рассчитать степень диссоциации слабой кислоты α по уравнению:
α = (kср / k0)·с ,
где kср – среднее значение константы скорости разложения мурексида в растворе слабой кислоты; с – концентрация раствора слабой кислоты.
Константу диссоциации рассчитывают по формуле:
kдис = α2c / (1-α) .
Рекомендуемые концентрации кислот для определения kдис: 0,005 М муравьиная кислота; 0,005 М лимонная кислота; 0,1 М уксусная кислота.
Для определения энергии активации Eакт кинетические измерения выполняют при двух температурах и рассчитывают константы kТ1 и kТ2 . Энергию активации находят по формуле:
Eакт = {2,3 RT1·T2·lg(k2/k1)} / (T2-T1) .
Дата добавления: 2016-02-27; просмотров: 2266;
