Жесткость воды и методы ее устранения
При выполнении задач по этой теме необходимо обратить внимание на следующее.
Различают жесткость некарбонатную (постоянную) и карбонатную (временную). Наличием в природной воде Са(НСО3)2 и Mg(HCO3)2 обусловливается карбонатная жесткость воды, некарбонатная - наличием хлоридов и сульфатов магния и кальция. Карбонатная и некарбонатная жесткость составляют общую жесткость воды в г-экв / л (миллиэквивалент/л, мэкв/л). В лаборатории карбонатную жесткость воды (Жврем.) обычно определяют методом титрования определенного объема воды раствором соляной кислоты известной концентрации в присутствии индикатора метилоранжа. При титровании протекают реакции:
Са(НСО3)2+2НСl ® CaCl2+2H2O+2CO2
Mg(HCO3)2+2HCl ® MgCl2+2H2O+2CO2.
Расчет производят по формуле: V1×Cн1 = V2×Cн2, где V1 - объем воды в мл; V2 - объем кислоты, затраченной на титрование; Cн1 - нормальность раствора солей в воде; Cн2 - нормальность кислоты. Отсюда: Сн1 = 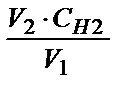 ; Ж = Сн1×103 (мэкв / л).
; Ж = Сн1×103 (мэкв / л).
При решении задач можно пользоваться формулой: Ж= 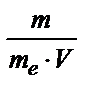 , где m - масса вещества в мг, обусловливающего жесткость воды, или соли, которую применяли для ее устранения; mэ - эквивалентная масса этого вещества; V - объем раствора в л.
, где m - масса вещества в мг, обусловливающего жесткость воды, или соли, которую применяли для ее устранения; mэ - эквивалентная масса этого вещества; V - объем раствора в л.
Чтобы устранить жесткость воды, нужно связать ионы Са2+ и Мg2+ в нерастворимые соединения, используя таблицу растворимости. Для осаждения ионов кальция и магния используют преимущественно соду Na2CO3, известь Са(ОН)2 или фосфат натрия Na3PO4. Временная жесткость воды может быть устранена длительным кипячением. При этом протекают следующие реакции:
Са(НСО3)2 ® CaCО3¯+Н2О+СО2
Mg(HCO3)2 ® Mg(OH)2¯+2CO2.
Задача 1. Предложите способы устранения временной и постоянной жесткости воды.
Решение. Для устранения временной жесткости, кроме метода кипячения, используют методы осаждения:
- Известковый метод: Са(НСО3)2+Са(ОН)2 ® 2СаСО3¯+2Н2О
Mg(HCO3)2+2Са(ОН)2®2СаСО3¯+Mg(OH)2¯+2H2O
- щелочной метод: Са(НСО3)2+2NaOH ®СаСО3¯+Na2CO3+2H2O
Mg(HCO3)2+4NaOH ® Mg(OH)2¯+2Na2CO3+2H2O
- содовый метод: Са(НСО3)2+Na2CO3® СаСО3¯+2NaHCO3
Mg(HCO3)2+ Na2CO3® MgCO3 ¯+2NaHCO3
Для удаления постоянной жесткости можно использовать:
- содовый метод: CaSO4+ Na2CO3® CaCO3¯+Na2SO4
MgSO4+Na2CO3® MgCO3¯+Na2SO4
- фосфатный метод: 3 CaSO4+2Na3PO4® Ca3(PO4)2¯+3Na2SO4
3MgSO4+2Na3PO4®Mg3(PO4)2¯+3Na2SO4
Задача 2.Вычислить жесткость воды, зная, что в 500 л ее содержится 202,6 г Са(НСО3)2.
Решение. Определяем эквивалентную массу Са(НСО3)2: mэ = 162 : 2 = 81 (г / моль). Находим жесткость воды по формуле:
Ж = 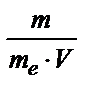 =
= 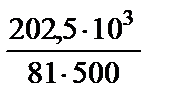 = 5 мэкв/л.
= 5 мэкв/л.
Задача 3. Вычислить карбонатную жесткость воды, зная, что на титрование 100 мл этой воды потрачено 6,25 мл 0,008 н. раствора НСl.
Решение. Подставляем данные в формулу: V1×CH1 = V2×CH2
100×Сн1 = 6,25×0,008 ; Сн1 = 0,005 экв/л.
Поскольку жесткость воды выражается в мэкв / л, то: Ж = Сн1×103 = 5 мэкв/л.
Дата добавления: 2016-02-27; просмотров: 1973;
