Коррозия металлов и защита металлов от коррозии
Коррозия металлов - самопроизвольный (спонтанный) процесс разрушения металла (ΔG <0), который протекает под действием окружающей среды и проходит с выделением тепла (ΔН <0) и рассеянием вещества (ΔS> 0). Коррозию следует отличать от эрозии - механического разрушения. Возможность протекания любой химической реакции, включая коррозию, определяется изменением энергии Гиббса ΔG. Поэтому становится понятным, почему возможна коррозия магния и даже меди в агрессивной среде, в то время как золото коррозии не поддается:
Mg + H2O(ж) + 1/2O2 ® Mg(OH)2 DG = -591,6 кДж;
Сu + H2O + 1/2O2 ® Сu(OH)2 DG = -119,5кДж;
Au + 3/2H2O + 3/4O2 ® Au(OH)3 DG = +65,6 кДж.
Коррозию классифицируют:
1. По геометрическому характеру коррозионных разрушений: сплошная (равномерная); межкристаллитная; неравномерная; питтинг; транскристаллитная; структурно-избирательная; пятнами; подповерхностная.
2. По механизму протекания коррозионных процессов:
а) химическая; б) электрохимическая: в) особые виды:
- газовая -контактная -биологическая
- жидкостная -концентрационная -радиационная
- электрокоррозия - ультразвуковая
Следует четко различать механизм протекания химической и электрохимической коррозии. Химическая коррозия - окислительно-восстановительный процесс разрушения металлов под действием окружающей среды, не сопровождающийся возникновением электрических коррозионных токов.
Газовая коррозия - наиболее распространенный вид химической коррозии, что обусловлено взаимодействием металлов с О2, SO2, H2S, CO, CO2 и другими газами. Химизм коррозии под воздействием кислорода выражается уравнением: nMe + O2 → MenOm , то есть, по механизму протекания коррозионных процессов - это обычная гетерогенная окислительно-восстановительная реакция.
Скорость окисления металла и защитные свойства оксидных пленок зависят от целостности оксидной пленки и скорости диффузии окислителя через пленку. Целостность пленки и ее защитные свойства определяется фактором Пиллинга-Бэдвордса (α), который определяется как a = 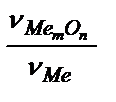 . Если a > 1, то такая пленка обладает защитными свойствами (подробно об этом читайте в учебнике В.В.Фролова). Например, для Mg α = 0,79. Следовательно, такая оксидная пленка не защищает магний от коррозии. Наоборот, для Al, Ni, Ti, Cr фактор Пиллинга - Бэдвордса равен 1,31, 1,52, 1,76 и 2,02 соответственно. Такие пленки обладают защитными свойствами. На поверхности некоторых металлов (Cr, Ni) образуются тонкие (до 40 мкм), незаметные глазу, но плотные оксидные пленки.
. Если a > 1, то такая пленка обладает защитными свойствами (подробно об этом читайте в учебнике В.В.Фролова). Например, для Mg α = 0,79. Следовательно, такая оксидная пленка не защищает магний от коррозии. Наоборот, для Al, Ni, Ti, Cr фактор Пиллинга - Бэдвордса равен 1,31, 1,52, 1,76 и 2,02 соответственно. Такие пленки обладают защитными свойствами. На поверхности некоторых металлов (Cr, Ni) образуются тонкие (до 40 мкм), незаметные глазу, но плотные оксидные пленки.
Жидкостная коррозия - это коррозия в среде жидкостей-неэлектролитов (бензин, керосин, толуол и др.).
Наибольший ущерб технике и промышленности наносит электрохимическая коррозия. Механизм контактной (гальванической) коррозии связан с возникновением микро- или макрогальванопар:
(-) анод Me1 │D│Me2 (+) катод
где D - деполяризатор (среда) (cмотрите тему "Гальванические элементы"). При этом анодный процесс – это процесс окисления (разрушения) более активного металла, а катодный - процесс восстановления, причем деполяризатором-окислителем выступают ионы Н+ (в кислой среде: 2Н+ + 2е → Н2) или О2 (в нейтральной или щелочной среде: О2 + 2Н2О + 4е → 4ОН-). Следует помнить, что технические металлы содержат примеси других металлов и неметаллов, что приводит к появлению микрогальванопар.
Необходимо обратить внимание, что электродные потенциалы металлов зависят от состава электролита и рН среды. Это необходимо учитывать на практике для правильного прогнозирования возможных коррозионных разрушений. Значения электродных потенциалов (В) некоторых металлов в различных средах приведены в таблице 10.
Т а б л и ц а 10
Значение ΔЕ0 металлов в различных средах
| Металл | E0 стандарт. | E(Me)n+/Me в 0,1н. HCl | E (Me)n+/Me в 3% NaCl |
| Al | -1,66 | -0,50 | -0,63 |
| Zn | -0,76 | -0,76 | -0,83 |
| Fe | -0,44 | -0,32 | -0,50 |
| Cu | -0,34 | -0,15 | -0,05 |
Согласно данным таблицы 7, электрохимический ряд напряжений нельзя считать абсолютной характеристикой свойств металлов. Так, в морской воде магний имеет потенциал -1,48 В (а не -2,38 В), цинк -0,80 (а не -0,76 В), титан -0,15 В (а не -1,63 В).
Концентрационная коррозия определяется градиентом концентрации деполяризатора, например, О2 (поверхностные слои воды содержат больше кислорода, чем внутренние), вследствие чего на поверхности металла образуются анодные и катодные участки:
Е = Е0 + 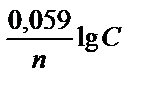 . Коррозии подвергается анодный участок:
. Коррозии подвергается анодный участок:
(-) А Fe│ O2, H2O │ Fe K (+)
Электрокоррозия - процесс, протекающий под влиянием постоянного электрического тока от внешнего источника (например, под воздействием блуждающих токов: ответвления тока от рельсов электрифицированного транспорта и др.).
Необходимо по учебникам ознакомиться с основными способами защиты металлов от коррозии, к числу которых относятся:
- создание рациональных конструкций;
- обработкa окружающей данную конструкцию среды (десульфуризация бензина, керосина, мазута, масел); герметизация приборов; применение ингибиторов коррозии;
- создание изолирующих пленок на металлах: низкотемпературных (смазки, лаки, краски) или высокотемпературных (хромирование, никелирование, цинкование, лужение);
- химическая обработка поверхности: оксидирования, азотирования, фосфатирование, цементация;
- защита металлов внешним потенциалом: протекторная, электрозащита;
- создание и применение новых сплавов, новых материалов.
Задача 1. Одна железная деталь покрыта алюминием, а другая - медью. Какое покрытие будет анодным, а какое катодным? Составьте схемы катодного и анодного процессов, которые будут протекать во влажной среде, если покрытие в обоих случаях нарушено. Какие продукты коррозии образуются в этих случаях?
Решение. Нарушение металлического покрытия при наличии электролита приводит к возникновению гальванопары, в которой покрытие может выполнять роль анода (анодные покрытия) или роль катода (катодные покрытия). Поскольку электродный потенциал железа меньше, чем у меди и больше, чем у алюминия, то покрытие алюминием является анодным, а медью - катодным.
При нарушении покрытия возникнут такие гальванопары:
a) (-) Al│O2, H2O │ Fe (+)
На аноде(-): Al – 3e ® Al3+ Е0 = - 1,66 В.
На катоде(+): 2H2O + O2 + 4e ® 4OH- E0 = 0,40 В.
Корродирует покрытие – алюминий: 4 Al + 6H2O + 3O2 = 4Al(OH)3 .
б) (-) Fe│O2, H2O │ Cu (+);
На аноде(-): Fe – 2e ® Fe2+ Е0 = - 0,44 В
На катоде(+): 2H2O + O2 + 4e ® 4OH- E0 = 0,40 В
Корродирует железо: 2Fe + 4 OH- = 2Fe(OH)2 .
Дальнейшее окисление идет согласно уравнению реакции:
2Fe(OH)2+ H2O + 1/2O2 ® 2Fe(OH)3,
И далее: Fe(OH)3 ® FeOOH + H2O.
Задача 2. Железные цистерны применяют для транспортировки концентрированной серной кислоты. Если из цистерны вылить кислоту и оставить цистерну на воздухе открытой, то она сравнительно быстро ржавеет. Почему? Составьте электронные уравнения для такого типа коррозии.
Решение. Известно, что пассивными участками (микрокатодами) в углеродистой стали является зерна карбида железа Fe3C. Зерна железа - микроаноды. В данном случае создается гальванопара "металл - соединение металла". Коррозия в кислой среде (в концентрированной серной кислоте железо пассивируется за счет образования защитной оксидной пленки) будет происходить с водородной деполяризацией:
(-) Fe │H2SO4 │ Fe3C (+);
На аноде(-): Fe0 – 2e ® Fe2+
На катоде(+): 2H+ + 2e ®H2
Fe0 + 2H+ = Fe2+ + H2
Задача 3. На основании расчета ΔG реакции определите вероятность коррозии во влажном воздухе. Какого металла - олова или свинца - будет больше, считая, что процесс протекает по схеме:
2Ме + 2Н2О + О2 ® 2Ме(ОН)2 .
Решение. Между величиной Э.Д.С. (ΔЕ) окислительно-восстановительной реакции и изобарно-изотермическим потенциалом (ΔG) существует линейная зависимость. ΔG равна максимальной работе системы: DG =Амакс; Амакс определяется соотношением: Амакс. = n×F×DЕ, где n - число электронов, отданных восстановителем или принятых окислителем; F - постоянная Фарадея (96500 Кл / моль).
Нетрудно вывести зависимость, связывающую уменьшение изобарно-изотермического потенциала и Э.Д.С.:
DG = - n×F×DЕ.
Рассчитаем ΔG для процесса коррозии олова: DGкорр.(Sn) = -4×96500×(0,40-(-0,14)) = -208440 Дж или -208,4 кДж. Проведем аналогичный расчет для процесса коррозии свинца: ΔGкорр.(Pb) = -4·96500·(0,40 - (- 0,13)) = -204 580 Дж или -204,6 кДж. На основании полученных данных делаем вывод, что вероятность процесса коррозии олова больше (более отрицательное значение ΔG).
Дата добавления: 2016-02-27; просмотров: 1568;
