Электролиз. Нанесение гальванопокрытий
При изучении данной темы и выполнении задач по ней необходимо обратить внимание на следующее:
Электролизом называется совокупность процессов, протекающих на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
Как и в гальваническом элементе, электрод, на котором при электролизе происходит восстановление, называется катодом, а электрод, на котором осуществляется процесс окисления, - анодом.
Для осуществления процесса электролиза собирают установку, состоящую из источника постоянного тока, электродов, емкости (электролизера), содержащий раствор или расплав электролита. Электролиз протекает не при любой разности потенциалов, а при вполне определенной, которая называется потенциалом разложения (ΔЕразл). Последний численно равен Э.Д.С. гальванического элемента, построенного на продуктах электролиза. Можно также рассчитать потенциал разложения по формуле:
ΔЕразл = 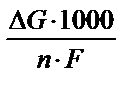
При электролизе расплава на аноде происходит окисление аниона, а на катоде - восстановление катиона. При электролизе растворов молекулы растворителя (в частности, молекулы воды) могут участвовать в процессах окисления-восстановления в соответствии со схемами:
Анод: а) рН 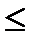 7 2Н2О –4е ® О2 + 4Н+ (Е0 = 1,23 В)
7 2Н2О –4е ® О2 + 4Н+ (Е0 = 1,23 В)
б) рН > 7 4ОН- - 4е ® 2Н2О + О2 (Е0 = 0,40 В)
Катод: а) рН < 7 2Н+ + 2е ® Н2 (Е0 = 0 В)
б) рН  7 2Н2О + 2е ® Н2 + 2ОН- (Е0 = -0,83 В).
7 2Н2О + 2е ® Н2 + 2ОН- (Е0 = -0,83 В).
Поэтому следует руководствоваться следующим правилом: на катоде в первую очередь протекает тот процесс, потенциал которого больше (то есть, смещен в более положительную область); на аноде в первую очередь протекает тот процесс, потенциал которого меньше. С учетом приведенных правил можно выделить три группы металлов в ряду напряжений:
I - от Li до Mn - ионы этих металлов в водных растворах не восстанавливаются (вместо них восстанавливаются молекулы воды);
II - от Zn до Sn - ионы металлов восстанавливаются одновременно с молекулами воды;
III - металлы, расположенные после водорода - ионы этих металлов легко восстанавливаются на катоде, молекулы воды практически не восстанавливаются.
Следует учитывать также возможность окисления материала анода (активный анод), а также процессы поляризации электродов, перенапряжения и т.п., которые могут изменить направление протекания процесса электролиза (более подробно с этим необходимо познакомиться по учебнику Фролова: гл. «Реальные электрохимические процессы» ).
Например, при электролизе водных растворов хлоридов (NaCl, CuCl2, SnCl2 и др.). На инертном аноде возможно протекание следующих процессов:
а) 2Cl- - 2ē → Cl2↑ (E0 Cl2/2Cl- = 1,36 B);
б) 2H2O - 4ē → O2↑ + 4H+ (E0О2+4H+/2H2O =1,23B).
Теоретически должен происходить процесс (б), его потенциал разложения меньше. На практике, в результате перенапряжения выделения О2 на величину от 0,5 до 1 В, потенциал разложения Н2О повышается, а потенциал окисления иона Cl- остается неизменным. Итак, в реальных условиях происходит процесс (а), выделяется хлор.
Следует иметь в виду, что реальный потенциал разложения (ΔЕпракт) всегда выше теоретического (ΔЕтеор):
ΔЕпракт = ΔЕтеор + IR + ΔEполяр + ΔЕконт ,
где ΔЕполяр - разность потенциалов вследствие протекания поляризационных процессов; ΔЕконт - падение потенциалов на контактах (контактная разность потенциалов). Наличие побочных процессов приводит к потерям электричества.
Ниже (таблица 11) приведены значения потенциалов перенапряжения выделения Н2 и О2 на электродах, изготовленных из различных металлов (ΔUH2 и ΔUO2).
Количественные расчеты процессов электролиза можно проводить с помощью законов Фарадея:
1. Массы или объемы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшего через электролит, и химическому эквиваленту вещества: m= k×I× 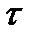 = k×Q .
= k×Q .
Так как k = mэ / F, то: m = (mэ·I·τ) / F ; для газов: V = (Vэ·I·τ) / F .
Т а б л и ц а 11
Потенциалы перенапряжения выделения Н2 и О2 на электродах
из различных материалов
| Значения ΔUH2 | |||||
| Материал электрода | ΔUH2, В | Материал электрода | ΔUH2, В | Материaл электрода | ΔUH2 , В |
| Pt (черн.) Pt (гладк.) Au W Ag | 0,00 0,09 0,15 0,22 0,30 | Ni Bi Fe Cu Sb Al | 0,31 0,40 0,45 0,36 0,60 0,70 | Zn Sn Cd Hg Pb C (графит) | 0,70 0,75 0,80 1,10 1,16 0,65 |
| Значения ΔUO2 | |
| Материал | ΔUO2, В |
| Pt (черн.) Pt (гладк.) Fe Ni Pb | 0,25 0,45 0,25 0,06 0,31 |
2. При прохождении через различные электролиты равного количества электричества на электродах выделяются массы веществ, пропорциональные их химическим эквивалентам:
если Q = const, то 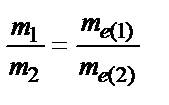 , где m - масса вещества, выделяющегося при электролизе;
, где m - масса вещества, выделяющегося при электролизе;
mэ- его эквивалентная масса, г;
I - сила тока, А;
τ - время, с;
F - число Фарадея (96500 Кл / моль (А·с / моль), или 26,8 А·час / моль, если время выраженный в часах);
Q - количество электричества, прошедшее через электролит, Кл;
k - электрохимический эквивалент, численно равный массе вещества (г), выделившегося при прохождении одного кулона электричества;
V - объем газообразного вещества, образовавшегося при электролизе;
Vэ - эквивалентный объем газообразного вещества.
На практике в результате протекания побочных процессов, происходящих на электродах, образуется меньше вещества, чем это отвечает расчетным формулам. Для характеристики истинного количества вещества, выделяющегося на электродах, используют величину η (греч. «эта»), называемую выходом по току:
 =
= 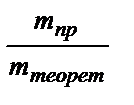 ×100%.
×100%.
Задача 1. Электрический ток силой 6 А пропускали через водный раствор нитрата натрия в течение 1,5 часа. Написать уравнения процессов, происходящих при электролизе с инертным анодом. Какие вещества и в каком количестве выделяются на электродах?
Решение. В водном растворе нитрат натрия диссоциирует по схеме:
NaNO3 « Na+ + NO3-
К (-) А (+)
Na+, H2O NO3-, H2O
Стандартный электродный потенциал системы Na+ + e → Na0 равен -2,71 В. Стандартный электродный потенциал восстановления воды -0,41 В. Поэтому на катоде будет происходить электрохимическое восстановление воды сопровождается выделением водорода: 2Н2О + 2е → Н2 + 2ОН-, а ионы Na+ и ОН- будут накапливаться в катодном пространстве. На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода: 2Н2О - 4е → О2 + 4Н+, а ионы NO3-, Н+ будут накапливаться в анодном пространстве. Таким образом, одновременно с выделением водорода и кислорода при электролизе водного раствора нитрата натрия образуется натрий гидроксид (в катодном пространстве) и азотная кислота (в анодном пространстве), если между катодом и анодом расположена диафрагма.
Суммарное уравнение: 4NaNO3 + 6Н2О → 2Н2 + О2 + 4NaOH + 4HNO3
Вычисляем количество кислорода и водорода по первому закону Фарадея:
V = 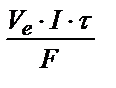 . Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л, кислорода – 5,6 л, а
. Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л, кислорода – 5,6 л, а 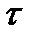 = 1,5 часа, то, подставив числовые данные, получим:
= 1,5 часа, то, подставив числовые данные, получим:
V 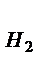 =
= 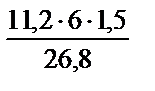 = 3,76 л; V
= 3,76 л; V  =
= 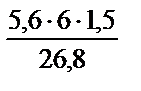 = 1,88 л
= 1,88 л
Задача 2. При электролизе раствора сульфата меди на аноде выделилось 168 см3 кислорода при н.у. Сколько граммов меди выделилось на катоде?
Решение. Используя закон эквивалентов, запишем:
Масса меди: mCu = 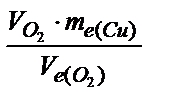 =
= 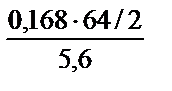 = 0,96 г . (Объем кислорода выражаем в системе СИ: 168 см3 = 168 мл = 0,168 л).
= 0,96 г . (Объем кислорода выражаем в системе СИ: 168 см3 = 168 мл = 0,168 л).
Задача 3. Электрический ток силой 2,5 А, проходя через раствор электролита, за 30 минут выделяет из раствора 2,77 г двухвалентного металла. Определите, какой это металл. Решение. Используя закон Фарадея (m 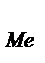 =
= 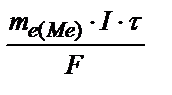 ), рассчитаем эквивалентную массу этого металла по формуле: m
), рассчитаем эквивалентную массу этого металла по формуле: m 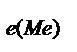 =
= 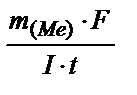 ; m
; m 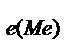 =
= 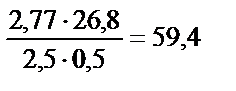 г/моль-экв.
г/моль-экв.
Эквивалентная масса связана с атомной массой соотношением: mэ = А/в (в - валентность металла), из которого следует: А = mэ·в = 59,4·2 = 118,5 г / моль. Данный металл - олово (Sn).
Дата добавления: 2016-02-27; просмотров: 1296;
