Режимы гальванопокрытий при восстановлении стальных и чугунных деталей
| Характеристики процессов гальванопокрытий | |||||
| Металл | Цинк Zn | Медь Cu | Никель Ni | Железо Fe | Хром Cr |
| Реакция электролита | кислая | кислая | кислая | кислая | кислая |
| Ионы | Zn2+ | Cu2+ | Ni2+ | Fe2+ | Cr6+ |
| Атомный вес | 63,8 | 65,57 | 58,69 | 55,84 | 52,01 |
| Электрохимический эквивалент (г×А/ч) | 1,220 | 1,186 | 1,095 | 1,043 | 0,323 |
| Плотность g (г/см3) | 7,0 | 8,9 | 8,8 | 7,9 | 6,8…7,1 |
| Толщина осадка (теоретическая/практическая) | 17,43/16,0 | 13,33/13,0 | 12,44/10,6 | 13,34/13,0 | 4,96/06 |
| Выход по току | 0,92 | 0,98 | 0,9 | 0,85…0,9 | 1,13…0,18 |
Приведенные в таблице данные свидетельствуют о необходимости исследований совместимости кристаллических решеток и молекулярных структур материала электролитического покрытия с материалом восстанавливаемой детали. При этом следует обратить внимание на особенности процессов восстановления стальных и чугунных деталей хромированием вследствие особенностей структур их молекул. Неплохие результаты по снижению так называемых «бандажных» внутренних напряжений обеспечивают процессы пористого хромирования, при которых нанесение слоя хрома на рабочую поверхность детали происходит не по принципу «оболочки», а по принципу «чешуи» см. рис. 3.22 [15].
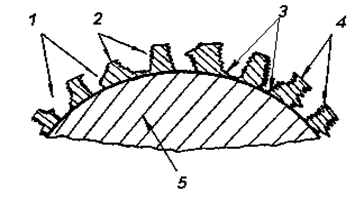
Рис. 3.22. Схема образования пористого хромового покрытия:
1 – поры; 2 – металл пористого гальванопокрытия; 3 – микротрещины; 4 – гребешки; 5 – металл основной детали
При совместимости металлов гальванопокрытий по плотности, атомному весу, электрохимическому эквиваленту и энергии осаждения положительные результаты дают процессы восстановления стальных и чугунных деталей «комбинированными» покрытиями. Так, например, при восстановлении стальных и чугунных деталей железомарганцевыми покрытиями (Fe-Mr) поверхностная твердость гальванопокрытия достигает величины Нв=(400…450). Состав электролита: двухлористый марганец MnCl2×4H2O – 350 г/л; продукт переработки соляной кислоты NH4Cl – (100…125) г/л; двухлористое железо FeCl2×4H2О – (30…50) г/л. При кислотности ванны 3,6 рН и температуре электролита 18 °С, при катодной плотности тока Dк – (5…8) А/дм2 скорость осаждения осадка составила (0,02…0,03) мм/ч, а наибольшая толщина h – до 1,0 мм.
Неплохие результаты обеспечивают процессы электрохимического осталивания, разработанные и примененные на ярославском объединении «Автодизель» при ремонте шатунов, посадочных поверхностей под вкладыши коренных подшипников для блока цилиндров и т.п. При этом необходима как теоретическая проработка процесса, так и его технологическая отладка по режимам гальванопокрытий для данного оборудования.
При нагружении металла восстанавливаемой детали в раствор гальванической ванны на границе «металл-раствор» образуется «двойной» электропроводящий слой и возникает разность потенциалов. «Двойной» электрический слой является своеобразным конденсатором, одна из обкладок которого образуется поверхностью металла, а другая – слоем катионов в растворе у поверхности металла.
Разность потенциалов j, возникающая между металлом восстанавливаемой в ванне детали и раствором его соли, так называемый «потенциал металла» может быть определен по уравнению Нернста для 18 °С:
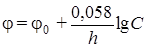 , (3.81)
, (3.81)
где j 0 – нормальный потенциал электрода; n – валентность ионов в растворе; С – концентрация ионов в растворе.
«Прикатодный» слой пополняется ионами путем диффузии, конвекции и миграции.
Процесс диффузии происходит в растворе под влиянием разности концентраций, процесс конвекции связан с движением в жидкости вследствие разности температур, миграция ионов происходит под действием электрических потенциалов в растворе. При невысоких температурах растворов (8…15) °С интенсивность движения ионов невелика, при температурах растворов (85…95) °С усиление конвекции в растворах также ухудшает осаждение металла вследствие нарушения «двойного» электрического слоя на катоде. Аналогичное действие оказывает и плотность катодного тока Dк, при повышении его величин выше критических может возникнуть эффект «холодного» кипения ванны. Для удаления излишков водорода на катоде иногда применяют «принудительное» механическое перемешивание электролита.
Дата добавления: 2016-03-10; просмотров: 839;
