СВОЙСТВА КОНСТРУКЦИОННЫХ И ИНСТРУМЕНТАЛЬНЫХ МЕТАЛЛОВ И ИХ СОЕДИНЕНИЙ. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ
В современной технике и промышленности роль металлов постоянно растет, так как они в ближайшем будущем остаются главными конструкционными и инструментальными материалами. Это обусловлено наличием таких важных свойств, как механическая прочность, твердость, термическая и химическая стойкость многих металлов и, особенно, их сплавов и композиций. Следует иметь в виду, что физические и химические свойства чистых металлов могут резко меняться в сплавах с другими металлами или при наличии в них даже небольших количеств некоторых неметаллов. Свойства чистых металлов и их сплавов необходимо знать и учитывать будущем инженеру, поскольку различные машины, приборы, аппараты и конструкции эксплуатируются в различных, иногда очень агрессивных средах.
Перспектива применения в промышленности металлов, их сплавов и композиций с широким набором практически полезных свойств послужила стимулом для разработки экономически обоснованных методов их получения и рационального использования. Химия металлов и их соединений оказалась одной из самых разработанных областей химической науки. В настоящее время в производственную деятельность вовлечено более полусотни чистых металлов; количество сплавов и композиций исчисляется десятками тысяч, а количество используемых в технике и промышленности металлосодержащих соединений составляет, очевидно, сотни тысяч.
Программой по химии для студентов нехимических специальностей предусмотрено рассмотрение свойств главных конструкционных и инструментальных металлов. Изучение свойств редких и рассеянных металлов может быть предложено наиболее успевающим студентам в рамках НИРС или при выполнении курсовых и дипломных работ. Ниже представлены лабораторные работы по химии металлов в такой последовательности: свойства легких конструкционных металлов, свойства тяжелых черных и цветных металлов.
Кроме известных учебников Н.Л.Глинки и В.В.Фролова, для ознакомления со свойствами элементов и их соединений можно использовать следующие учебники: Г.П.Лучинский. Курс химии. - М.: Высшая школа, 1985. 416 с .; Н.С. Ахметов. Общая и неорганическая химия. - М.: Высш. шк., 1981. - 679 с. Прекрасным справочным пособием для углубленного изучения химии элементов являются учебники: Б.В.Некрасов. Основы общей химии (в трех томах - 1965, 1967, 1970 гг.). - М.: Химия; Ф.Коттон, Дж. Уилкинсон. Современная неорганическая химия (в трех томах). - М.: Мир, 1969. Полезную информацию можно найти в Химической энциклопедии (в пяти томах) - М.: Изд-во «Советская энциклопедия», 1988-1998 г.
При изучении химии конкретного металла и его соединений необходимо руководствоваться следующим планом.
1. Положение металла в периодической системе элементов Д.И. Менделеева, строение атома, возможные степени окисления.
2. Физические и эксплуатационные (механические) свойства металла (плотность, температура плавления, твердость, пластичность, полиморфизм и т.п.)
3. Химические свойства металла:
а) отношение к элементарным окислителям (галогенам, халькогенам (O2, S, Se), N2, P, C, B);
б) отношение к воде (при различных температурах);
в) отношение к щелочам (в растворе или расплаве);
г) взаимодействие металла с концентрированными и разбавленными кислотами (соляной, серной, азотной, уксусной) и их смесями.
4. Свойства соединений металла в разной степени окисления (оксиды, гидроксиды, кислоты, соли). Окислительно-восстановительные свойства соединений. Комплексные соединения с неорганическими и органическими лигандами.
5. Распространение металла в земной коре. Методы получения.
6. Использование металла, его сплавов и соединений в технике и промышленности.
Свойства легких конструкционных металлов (Be, Mg, Al, Ti)
Из всего многообразия металлов в легких конструкционных металлов могут быть отнесены только четыре металлы - Be, Mg, Al и Ti, причем, как конструкционный материал магний используется исключительно в виде сплавов. Это связано с очень высокой реакционной способностью магния. Оксидная пленка магния, в отличие от оксидных пленок бериллия, алюминия и титана, не имеет защитных свойств (найдите по учебнику В.В.Фролова значение фактора Пиллинга-Бэдвордса α для указанных металлов и сравните их).
Бериллий и его соединения очень ядовиты, что необходимо учитывать при работе с ними; при попадании на кожу рук соединений Be2+ надо смыть их водой и тщательно вымыть руки мылом.
Бериллий и магний - s-элементы (ns2).

Характерные степени окисления 0 и +2. Необходимо обратить внимание на различия в свойствах бериллия и магния. Бериллий, в отличие от магния, растворим в растворах щелочей, поскольку гидроксид бериллия амфотерный (рассмотрите механизм растворения бериллия в водных растворах щелочей). Оксидная пленка пассивирует бериллий, поэтому концентрированную серную кислоту бериллий восстанавливает до SO2, а магний - до H2S. Для магния нехарактерно образования комплексных соединений; для бериллия известны гидроксокомплексы, галогенидные и некоторые другие комплексы.
Алюминий относится к р-элементам (ns2np1), а титан - к d-элементам ((n-1) d2ns2):


Для алюминия характерен положительный степень окисления +3; титан в соединениях проявляет степени окисления +2, +3 и +4. Обратите внимание на изменение кислотно-основных свойств оксидов и гидроксидов титана в разной степени окисления: TiО - типичный основный оксид, тогда как TiО2 обладает амфотерными свойствами. Оксидные пленки на поверхности алюминия и титана пассивируют их, что позволяет использовать титан и алюминий в промышленности и технике как в чистом виде, так и в виде сплавов.
Задача 1. При растворении 0,39 г сплава магния с алюминием в 50 г 5% раствора НСl выделилось 448 мл газа (измеренного при нормальных условиях). Вычислить состав сплава в процентах и по массе.
Решение. Магний и алюминий реагируют с НСl, вытесняя из кислоты водород:
Mg + 2HCl ® MgCl2 + H2
Al + 3HCl ® AlCl3 + 1,5 H2.
Пусть в 0,39 г сплава содержится х моль Mg и у моль Al, тогда mсплава = Ммg×x + MAl ×y = 24x + 27y = 0,39.
В соответствии с уравнениями реакций на 1 моль Mg выделяется 1 моль Н2, а на х моль Mg - х моль Н2. На 1 моль Al выделяется 1,5 моль Н2, а на у моль Al - 1,5у моль Н2. Тогда справедливо записать: 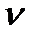 Н
Н 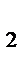 = х + 1,5у. Число моль водорода, виделяющегося по условию задачи, находим по формуле:
= х + 1,5у. Число моль водорода, виделяющегося по условию задачи, находим по формуле:
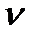 Н
Н 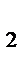 =
= 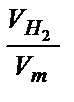 =
= 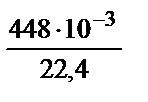 = 0,02 моль.
= 0,02 моль.
Решая систему уравнений:

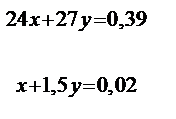 } ,
} ,
получаем х = 0,005 моль (Mg); у = 0,01 моль (Al). Находим массы магния и алюминия в 0,39 г сплава:
mMg = 24×0,005 = 0,12 г; mAl = 27×0,01 = 0,27 г
Находим массовые доли компонентов сплава:
 % (Mg) =
% (Mg) = 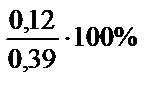 = 30,8%;
= 30,8%;  % (Al) =
% (Al) = 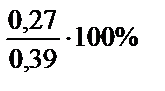 = 69,2%.
= 69,2%.
Задача 2. Возможна ли реакция восстановления TiО2 (кр.) углеродом при температурах 1000 и 3000 К? Ответ подтвердите расчетами ΔG0 по уравнению Гиббса-Гельмгольца.
Решение. Восстановление TiО2 углеродом протекает по уравнению:
TiО2 (к) + 2С (гр) →Ti (к) + 2СО (г).
Воспользуемся уравнением Гиббса-Гельмгольца: DG0 = DН0 - Т×DS0 и рассчитаем DН0 и DS0 химической реакции, пользуясь вторым следствием из закона Гесса.
DН0х.р. = 2DН0СО - DН0TiО 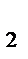 = 2×(-110,5) – (-943,9) = - 722,9 кДж.
= 2×(-110,5) – (-943,9) = - 722,9 кДж.
DS0х.р. = (DS0Ti + 2DS0CO) – (DS0TiО 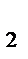 +2DS0C) = 30,7 +2×197,9 – 50,3 - 2×5,7 = 364,8 Дж/К = 0,365 кДж/К.
+2DS0C) = 30,7 +2×197,9 – 50,3 - 2×5,7 = 364,8 Дж/К = 0,365 кДж/К.
При температуре 1000К DG0х.р. = -722,9 - 1000·0,365 = - 355,9 кДж.
При температуре 3000К DG0х.р. = -722,9 - 3000·0,365 = - 1817,9 кДж. Таким образом, при обоих температурных значениях указанная реакция возможна.
Задача 3. При работе гальванического элемента: Al |Al2(SO4)|| Cr2(SO4) | Cr
восстановилось до свободного металла 31,2 г хрома. Написать уравнения электродных процессов. На сколько уменьшилась масса алюминиевого электрода?
Решение.
А (-) 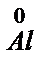 – 3e ® Al3+
– 3e ® Al3+
K (+) Cr3+ + 3e ® 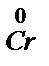
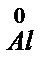 + Cr3+ = Al3+ +
+ Cr3+ = Al3+ + 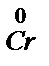
Уменьшение массы алюминиевого анода рассчитаем, применив закон эквивалентов: 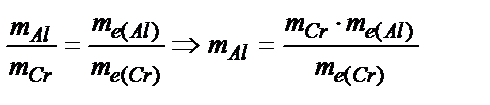 . По формуле: mэ(Al) =
. По формуле: mэ(Al) = 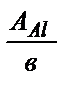 находим эквивалентную массу алюминия,
находим эквивалентную массу алюминия, 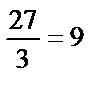 г / моль. Аналогично рассчитываем эквивалентную массу хрома:
г / моль. Аналогично рассчитываем эквивалентную массу хрома:
mэ(Cr) = 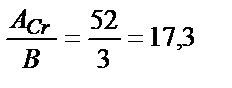 г / моль. Тогда mAl =
г / моль. Тогда mAl = 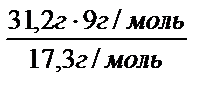 = 11 г.
= 11 г.
Дата добавления: 2016-02-27; просмотров: 1132;
