Получение порошков Co и Ni
Небольшое количество оксалата кобальта помещают в пробирку и нагревают в пламени горелки до полного разложения соли. Аналогичный опыт повторяют с оксалатом никеля. Составляют уравнения реакций разложения солей.
Опыт 2. Отношение Fe, Co, Ni к разбавленным и концентрированным кислотам: H2SO4, HNO3, HCl
а) взаимодействие железа с кислотами
В три пробирки наливают по ~1 мл 2н. растворов кислот: соляной, азотной, серной. В каждую пробирку помещают немного железных стружек. Наблюдают происходящие реакции. Затем в каждую пробирку добавляют несколько капель роданида калия. Наблюдают появление в одной из пробирок (какой?) красной окраски раствора. Аналогичный опыт проводят с концентрированными кислотами.
б) взаимодействие Co и Ni с кислотами
Испытывают отношение кобальта и никеля к кислотам, которые использовались в опыте 2 а. В отдельные пробирки помещают небольшое количество Со и Ni, полученные в опыте 1 и испытывают их отношение к кислотам (HCl, H2SO4, HNO3). Слегка подогревают пробирки и наблюдают выделение газообразных продуктов. Указывают, какого цвета образуются растворы. Записывают уравнения реакций.
В выводах укажите:
- Какие ионы являются окислителями в каждой из этих реакций?
- Чем объяснить, что при взаимодействии Fe с H2SO4 различной концентрации образуются соли железа в разной степени окисления?
Опыт 3. Получение и свойства гидроксидов Fe(2+), Co(2+), Ni(2+)
а) В три пробирки наливают по 1 мл растворов солей железа (2+), кобальта (2+), никеля (2+). Добавляют равные объемы раствора NaOH. Отмечают цвет осадков. Записывают уравнения реакций.
К первым двум осадкам доливают по 2-3 капли раствора H2O2, а к последнему - бромной воды (Br2). Составляют уравнения реакций окисления. Отмечают изменение цвета осадков.
В заключении укажите: у какого из гидроксидов слабее выражены восстановительные свойства.
б) по вышеприведенной методике получают сначала гидроксиды соответствующих металлов. Затем в каждую из пробирок по каплям добавляют 25% -ный раствор аммиака до растворения гидроксидов вследствие образования комплексных солей. Отмечают цвет растворов. Записывают уравнения реакций диссоциации соответствующих комплексных солей, комплексных ионов.
В заключении укажите: на основании Кнест комплексных аммиакатов Fe(2+), Co(2+), Ni(2+), какой комплексный ион прочнее.
Опыт 4. Комплексные соединения
а) В пробирку наливают 1 мл соли Fe3+, добавляют несколько капель роданида аммония NH4SCN. Отмечают цвет полученного раствора. Записывают уравнение реакции. Содержимое пробирки разделяют на две части. В первую добавляют ½ мл раствора ортофосфорной кислоты Н3PO4. Отмечают изменение окраски. Записывают уравнение реакции. Во вторую пробирку добавляют ½ мл фтористоводородной кислоты НF или раствора ее соли (в кислой среде). Отмечают изменение цвета. Записывают уравнение реакции.
В заключении укажите, почему произошло обесцвечивание раствора в обоих пробирках?
б) Небольшое количество безводных солей NiCl2 и CoCl2 растворяют в воде. Отмечают цвет исходных солей и растворов аквакомплексов. Записывают уравнение реакции образования аквакомплексов и их первичной диссоциации.
в) К 1 мл насыщенного раствора соли кобальта (2+) добавляют 2 мл насыщенного раствора NH4SCN. Отмечают синее окрашивание полученного раствора. Составляют уравнение реакции образования комплексного кобальтата, с учетом того, что координационное число Со2+ равно четырем.
Раствор разбавляют водой, перемешивают, добавив несколько капель спирта. Наблюдают изменение окраски. Затем в ту же пробирку доливают дистиллированную воду до окрашивания раствора в розовый цвет. Записывают уравнение реакции получения аквакомплекса Со2+ (КЧ = 6), уравнение диссоциации комплексного иона, приводят выражение Кнест. со значением, найденным по таблице.
В заключении укажите: какова роль воды и спирта в смещении равновесия диссоциации комплексного иона.
г) В пробирку наливают 1 мл соли никеля (2+) и ½ мл аммиачного раствора диметилглиоксима. Отмечают цвет выпавшего осадка. Записывают уравнение реакции образования нерастворимого комплексного хелата диметилглиоксимата никеля:

(Пунктиром обозначен водородная связь). Реакцию используют для обнаружения ионов никеля в растворе. В заключении укажите:
- Какой тип связи Ni - Lig?
- Каков механизм образования связи Ni – Lig?
Опыт 5. Окислительно-восстановительные свойства соединений железа
а) Восстановительные свойства Fe(2+). К 1 мл соли Fe(2+) доливают ½ мл 2 н. раствора Н2SO4 и ½ мл 3% раствора Н2О2 перекиси водорода. Затем добавляют несколько капель NH4SCN. Отмечают появление красного цвета раствора. Записывают уравнение реакции. Рассчитывают Э.Д.С. данного процесса.
В заключении укажите:
- Почему Fe(2+) проявляет свойства восстановителя?
- Для чего добавляли NH4SCN?
б) Окислительные свойства Fe(3+). В пробирке смешивают 1 мл соли Fe(3+) и ½ мл КI. Добавляют 2 - 3 капли раствора крахмала. По характерной окраске выявляют образование элементарного иода. Записывают уравнение реакции. Рассчитывают Э.Д.С.
В заключении укажите, может ли Fe(3+) выявлять и восстановительные свойства.
Опыт 6. Химическое никелирование (Элементы НИРС)
Химическое никелирование - окислительно-восстановительная взаимодействие ионов никеля (окислителя) с восстановителем, например, гипофосфиты натрия, в результате которого на поверхности металла образуется слой никеля: 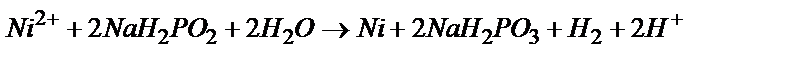 .
.
В химический стакан (100 мл) наливают 75 мл специального раствора: (30 г NiCl2, 10 г Na2НPO2 + 10 г CH3COOH в 1 литре раствора). Нагревают его на слабом огне до 950С (контроль термометром).
Очищают от ржавчины стальную пластинку сначала наждачной бумагой, затем мелом, промывают ее в струе воды и аккуратно опускают в приготовленный раствор, не касаясь поверхности пластинки. Никелирование осуществляют в течение ½ часа. Затем пластинку вынимают из раствора, промывают в струе воды, сушат между полосками фильтровальной бумаги. Анализируют визуально качество покрытия пластинки никелем.
Дата добавления: 2016-02-27; просмотров: 724;
