Отношение Mg, Al и Ti к воде
а) В 3 пробирки наливают по 3 мл воды, 1 капли фенолфталеина и вносят в одну пробирку немного порошка магния, в другую - стружку алюминия, в третью - стружку титана. На холоде ни один из указанных металлов не вытесняет водород из воды, поэтому содержание трех пробирок нагревают до кипения. Отмечают появление розовой окраски в одной из пробирок (какой?). Составляют уравнение протекающей реакции.
В заключении укажите, почему с водой реагирует только один из трех металлов.
б) Пробирки охлаждают, добавляют в каждую несколько капель насыщенного раствора NaCl и немного подогревают. Что происходит в пробирке с алюминием? Какую роль играют хлорид-ионы?
Опыт 2. Отношение Mg, Al и Ti к щелочам
В три пробирки помещают соответствующие металлы и доливают в каждую около 2 мл 2н. раствора NaOH или KOH. Отмечают выделение водорода только в пробирке с алюминием. Пробирки подогревают. Отмечают, где произошли изменения. Добавленная щелочь растворяет оксидную пленку на алюминие с образованием гидроксоалюмината и дает возможность взаимодействовать алюминия с водой. Схема взаимодействия:
1) 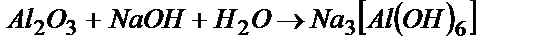 ;
;
2)  ;
;
3)  .
.
Подберите коэффициенты к данным уравнений.
Опыт 3. Отношение Mg, Al и Ti к кислотам
а) взаимодействие металлов с разбавленными кислотами (опыт проводят под тягой).
В четыре пробирки наливают по 1-2 мл растворов разбавленных соляной, серной, азотной и уксусной кислот. В каждую из них помещают небольшое количество порошка магния.
Аналогичный опыт повторяют с алюминием и титаном. Если реакции не проходят на холоде, пробирки осторожно подогревают. Отмечают выделение газообразных продуктов в каждом из случаев. Записывают уравнения реакций, с учетом того, что титан окисляется до Ti (3+). Азотная кислота пассивирует титан, образуя на его поверхности прочную оксидную пленку. При ее повреждении титан окисляется до метатитановой кислоты H2TiО3;
б) Взаимодействие металлов с концентрированными кислотами (опыт проводят под тягой). Выполняют опыт, аналогичный опыту 3а, заменив разбавленные кислоты концентрированными. Отмечают характер протекания реакций на холоде и при нагревании. Записывают уравнения протекающих реакций, учитывая, что с концентрированной серной кислотой образуется соль Ti (4+), а алюминий пассивируется концентрированой HNO3.
В заключении укажите, от каких факторов зависят продукты восстановления азотной и серной кислот.
Опыт 4. Получение и определение свойств гидроксидов Be2+, Mg2+, Al3+, Ti2+
В 4 пробирки доливают по 2-3 мл растворов солей соответствующих металлов (Be2+, Mg2+, Al3+, Ti2+). Затем добавляют в каждую пробирку по каплям 2н. раствор NaOH до выпадения осадков гидроксидов. Выпавшие осадки разделяют на 2 части. К первому осадку добавляют по каплям 2 н. раствор HCl, ко второму - раствор NaOH. Отмечают растворения осадков в случае гидроксидов Ве(2+) и Al(3+). В случае Ti(4+) выпадает гидроксид оксотитана TiО(OH)2, который растворяется в кислоте при нагревании и не растворяется в водных растворах щелочей. Записывают уравнения соответствующих реакций.
В заключении укажите, кислотные, основные или амфотерные свойства проявляют исследуемые гидроксиды.
Опыт 5. Восстановительные свойства Mg и Al
В две пробирки с растворами K2Cr2O7 и КМnО4 добавляют по 1 мл H2SO4 и вносят немного стружки Mg. Наблюдают изменение первоначального окраски растворов. Составляют уравнение реакции, используя электронно-ионный метод, с учетом того, что  восстанавливается до
восстанавливается до 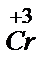 , а
, а 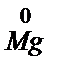 окисляется до
окисляется до 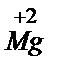 . Выполняют аналогичные опыты с порошком алюминия. Составляют уравнения реакций.
. Выполняют аналогичные опыты с порошком алюминия. Составляют уравнения реакций.
Опыт 6. Окислительно-восстановительные свойства соединений титана
а) Наливают в пробирку 3-5 мл 2 М раствора серной кислоты и всыпают микрошпателем немного порошка титана, подогревают до появления фиолетовой окраски раствора. Полученный раствор Ti2(SO4)3 разделяют на две части. В первую часть добавляют по каплям раствор FeCl3, а во вторую - раствор КМnО4 до полного исчезновения окраски. Записывают уравнения реакций восстановления Fe3+ до Fe2+ и MnО4- до Mn2+ сульфатом титана (3+).
б) В пробирку с раствором сульфата оксотитана вносять 1-2 мл 2М раствора H2SO4 и гранулу Zn. Пробирку нагревают до окраски раствора в фиолетовый цвет, характерный для иона Ti(3+). Записывают уравнение реакции, используя электронно-ионный метод. Переносят 2-3 капли фиолетового раствора Ti(3+) в чистую пробирку и встряхивают 2-3 минуты. Отмечают изменение цвета раствора. Записывают уравнение реакции окиснння Ti(3+) в соли титана (4+) кислородом воздуха при участии в реакции молекул воды.
Опыт 7. Электрохимическое оксидирование (анодирование) алюминия (элементы НИРС)
Электрохимическое оксидирование алюминия заключается в его анодной обработке в растворе серной, фосфорной, хромовой или щавелевой кислот и проводится с целью придания изделию антикоррозионных и декоративных свойств. Реакция анодного окисления алюминия может быть представлена уравнением: 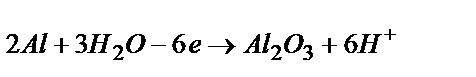 .
.
Оксидная пленка, образующаяся толщиной до 500 мкм имеет хорошие адсорбционные свойства, благодаря чему ее можно красить.
Алюминиевую пластинку погружают на 1-2 мин. в 10% -ный раствор едкого натра для обезжиривания и снятия оксидной пленки. Промывают водой и присоединяют в качестве анода к клеммам крышки электролизера. Катодом является свинцовая пластинка. Наливают в электролизер 20% -ный раствор серной кислоты, включают ток и опускают электроды. Быстро регулируют реостатом силу тока (плотность тока должна быть 0,8 - 2 А/дм2, а напряжение 10-12 В).
Через 20 мин. отключают электролизер от источника тока, снимают алюминиевую пластинку, промывают водой и описывают ее внешний вид. Для окраски пластины в желаемый цвет опускают ее в приготовленный заранее раствор анилиновых красителей (см. табл.13) на 10-15 мин., после чего промывают в холодной воде и осторожно высушивают на воздухе, а затем в термостате при 80-900С.
Т а б л и ц а 13
Состав водных растворов для получения анодированного алюминия
| Цвет пленки | Состав раствора | Температура раствора, 0С |
| Черный | Анилиновый черный (для шерсти) + анилиновый черний «ФФ» (массовая доля красителей по 0,5%) | 80-90 |
| Синий | Анилиновый голубой (массовая доля красителя 1%) | 20-25 |
| Желтый | Анилиновый желтый (массовая доля красителя 1%) | 20-25 |
| Красный | Анилиновый красный (массовая доля красителя 1 %) | 20-25 |
| Бронзовый | Краситель оранжевый марки «2ж» 0,1 г/л, сода Na2CO3 0,05 г/л |
Сравните коррозионную стойкость алюминия, анодированного без пропитки, анодированного с пропиткой красителем и необработанного, погружая пластинки в раствор CuSO4, подкисленный серной кислотой с добавкой хлорида натрия (можно использовать также раствор CuCl2). При необходимости окрашенную пленку можно снять с поверхности алюминиевых изделий 50% -ным раствором азотной кислоты.
Дата добавления: 2016-02-27; просмотров: 1149;
