Свойства металлов подгруппы Cr и Mn и их соединений
Элементы обеих подгрупп относят к семейству d - металлов. Для хрома и молибдена характерно явление провала электрона: ((n-1)d5ns1), в отличие от вольфрама (5d46s2), у которого провал электронов не наблюдается:


Cr, Mo W
Высшая степень окисления этих элементов (+6) соответствует номеру группы и определяется суммой электронов, находящихся на s-подуровне внешнего и d-подуровне предпоследнего электронного уровня. Для элементов подгруппы марганца (Mn, Tc, Re) валентные электроны распределены в соответствии с формулой ((n-1) d5ns2):

Mn
Высшая степень окисления +7 соответствует номеру группы, наименьшая положительная степень окисления +2. Однако существует целый ряд промежуточных степеней окисления (см. список рекомендованной литературы). С повышением степени окисления усиливаются кислотные свойства оксидов и соответствующих им гидроксидов, а основные ослабевают.
Наиболее характерные оксиды:
CrО Cr2O3 CrО3
MnО MnО2 MnО3 , Mn2O7
основные амфотерные кислотные
кислотные свойства усиливаются →
Амфотерность оксидов Cr2O3, MnО2 или соответствующих им гидроксидов можно доказать в реакциях их с кислотами и щелочами.
С повышением степени окисления элемента усиливаются окислительные свойства данного соединения, а восстановительные ослабевают, то есть:
Cr+2 ® Cr+3 ® Cr+6
Mn+2 ® Mn+4 ® Mn+7
усиливаются окислительные свойства
усиливаются восстановительные свойства
Окислительная способность ионов в максимальной степени окисления в значительной степени зависит от среды, в которой протекает окислительно-восстановительная реакция, и сильнее всего проявляется в кислой среде.
В растворе Cr+6 и Mn+7 существуют в виде ионов CrО42-, Cr2O72- (или других более сложных ионов) и MnО4- соответственно. Для элементов подгруппы хрома (Cr, Mo, W) характерно образование сложных изополи- и гетерополианионов: [Cr3O10]2- -трихроматы, [Cr4O13]2- -тетрахроматы. Все указанные элементы - хорошие комплексообразователи. Они образуют широкий спектр комплексных соединений, отличающихся по геометрическому строению, химическому составу и степеням окисления центрального атома:
Mn-3: Na3[Mn(NO)3CO];
Cr-2: Na2[Cr(CO)5]; Mn-2: Na2[Mn(фталоцианин)];
Cr-1: Na2[Cr2(CO)10]; Mn-1:Na[Mn(CO)5];
Cr0: Cr(CO)6; Mn0: Mn2(CO)10;
Mn+1: Mn(CO)5Cl;
Cr+2: CrF2, CrCl2, [Cr(bipy)2]2+; Mn+2: K2[MnCl4], [Mn(H2O)6]Cl2;
Cr+3: [Cr(NH3)6]3+, Na[Cr(OH)4]; Mn+3: K2[MnCl5];
Cr+4: K2[CrF6]; Mn+4: K2[MnCl6];
Cr+5: K2[CrOCl5];
Cr+6: Na2CrO4, CrO2Cl2. Mn+6: K2MnO4;
Mn+7: KMnO4, MnO3F.
Задача 1. Определите продукты реакции, подберите коэффициенты в уравнении и определите Э.Д.С. реакции: Na3[Cr(OH)6] + Br2 + NaOH =
Решение. В составе гексагидроксохромита хром(3+) в щелочной среде является восстановителем, а бром - окислителем, тогда, применив ионно-электронный метод, следует записать:
[Cr(OH)6 ]3-+ 2OH- - 3 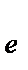 ® CrO42- + 4H2O 2 E0= -0,13 B
® CrO42- + 4H2O 2 E0= -0,13 B
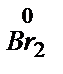 + 2
+ 2 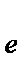 ® 2 Br- 3 E0= 1,065 B
® 2 Br- 3 E0= 1,065 B
2 [Cr(OH)6]3- + 3Br2 + 4OH- = 2 Cr42- + 8H2O + 6 Br-
Таким образом, в продуктах реакции: вода, бромид натрия, хромат натрия. Уравнение имеет молекулярный вид:
2 Na3[Cr(OH)6] + 3 Br2 + 4NaOH ® 2 Na2CrО4 + 6 NaBr + 8 H2O
Э.Д.С. = Еок. – Е восст. = 1,065 – (-0,13) = 1,195 В.
Задача 2. Допишите уравнения реакций, подберите коэффициенты и рассчитайте массу 10% раствора HCl, необходимую для выделения 44,8 л (н.у.) Cl2 в реакциях, указанных ниже:
а) KMnО4 + HCl ® Cl2 ....
б) K2Cr2O7 + HCl ® Cl2 ...
Решение. Подберем коэффициенты в этих уравнениях, используя ионно-электронный метод:
а) 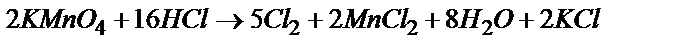 ;
;
MnO4- + 8H+ + 5 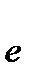 ®Mn2+ + 4H2O 2
®Mn2+ + 4H2O 2
2Cl- - 2 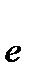 ®
® 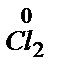 5
5
2MnO4- + 16H+ + 10 Cl- = 2Mn2+ + 8H2O + 5Cl2
б) 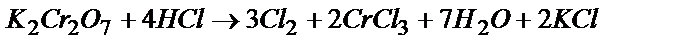
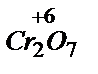 2- +14H+ + 6
2- +14H+ + 6 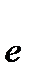 ®2Cr3+ + 7H2O 1
®2Cr3+ + 7H2O 1
2Cl- -2 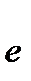 ®
® 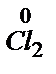 3
3
Cr2O72- + 14 H+ + 6Cl- = 2Cr3+ +7H2O + 3Cl2
Из формулы 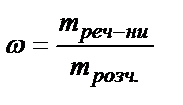 Þ
Þ 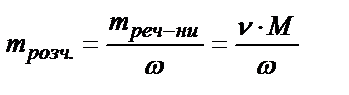 .
.
В случае а) 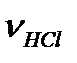 находим по уравнению: 6,4 ммоль, откуда
находим по уравнению: 6,4 ммоль, откуда 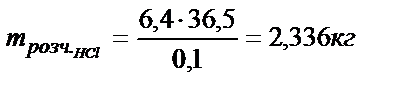
В случае б) 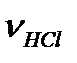 находим по уравнению: 6,4 ммоль, откуда
находим по уравнению: 6,4 ммоль, откуда 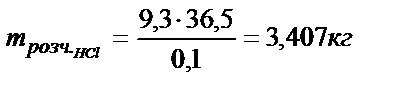
Задача 3. Выполните преобразования:
Cr2O3 ® K2CrО4 ® K2Cr2O7 ® Cr2(SO4)3®K3[Cr(OH)6]
Решение.
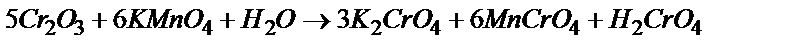
Сr2O3 + 5H2O - 6  ®2Cr42- + 10H+ 5
®2Cr42- + 10H+ 5
MnO4- + 8H+ + 5  ® Mn2+ + 4H2O 6
® Mn2+ + 4H2O 6
5Cr2O3 + H2O+6MnO4- = 10CrO42- + 2H+ +6Mn2+
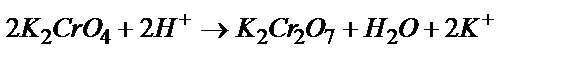
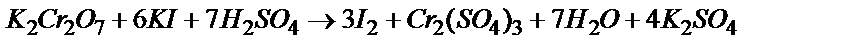
Cr2O72- +14H+ +6  ® 2Cr3+ +7H2O 1
® 2Cr3+ +7H2O 1
2I- - 2 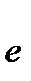 ®
® 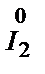 3
3
Cr2O72- + 14H++2I- = 2Cr3+ + 7H2O + 3I2
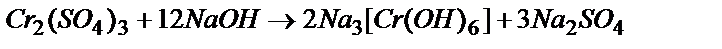
2Cr3+ + 12OH- ® 2[Cr(OH)6]3-
Дата добавления: 2016-02-27; просмотров: 2032;
