Свойства железа, кобальта, никеля
Указанные элементы относятся к I триаде восьмой группы и резко отличаются по свойствам от элементов II и III триады. Исходя из электронных формул и распределения электронов по квантовым ячейкам:

26Fe ... 3d64s2

27Co ...3d74s2

28Ni ...3d84s2
можно прогнозировать следующие степени окисления: для Fe от 0 до +6 (недавно получено соединение  ), для Со от 0 до +5 (комплексные соединения малочисленны и малоизученные), для Ni - от 0 до +4. Таким образом, в ряду: Fe-Co-Ni, четко прослеживается тенденция к снижению устойчивости высших сословий окисления. Программой курса химии для нехимических специальностей предусмотрено изучение свойств металлов и их соединений, в которых ионы металлов имеют наиболее типичные степени окисления - Fe: +2, +3, +6; Co: +2, +3 и Ni: +2, +3.
), для Со от 0 до +5 (комплексные соединения малочисленны и малоизученные), для Ni - от 0 до +4. Таким образом, в ряду: Fe-Co-Ni, четко прослеживается тенденция к снижению устойчивости высших сословий окисления. Программой курса химии для нехимических специальностей предусмотрено изучение свойств металлов и их соединений, в которых ионы металлов имеют наиболее типичные степени окисления - Fe: +2, +3, +6; Co: +2, +3 и Ni: +2, +3.
Стандартные электродные потенциалы железа, кобальта и никеля (-0,44; -0,27 и -0,25В соответственно) свидетельствуют о том, что эти металлы относятся к среднеактивным.
Решая вопрос об отношении Fe, Co, Ni в водных растворов щелочей, кислот, необходимо помнить, что очень концентрированные серная и азотная кислоты пассивируют железо и никель. В разбавленных неокисляющих кислотах (Н2SO4, HCl) эти металлы растворяются с образованием соединений Fe(2+), Co(2+), Ni(2+). Необходимо иметь в виду, что если в степени окисления +2 для всех этих элементов известны оксиды, гидроксиды и соли (простые и комплексные), то в степени окисления +3 Co и Ni не образуют простых солей. Поэтому в реакции: Ni2O3 + HCl → ... стоит ожидать образование не NiCl3, а NiCl2 (окислительно-восстановительная реакция):
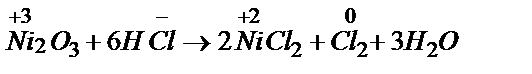
2Ni3+ +  2e ® 2Ni2+ окислитель
2e ® 2Ni2+ окислитель
2Cl- - 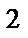 e ®
e ® 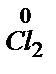 восстановитель
восстановитель
Типичные металлы в степенях окисления +2, +3, +6 дают оксиды, для которых характерны основные, амфотерные и кислотные свойства соответственно. Fe, Co, Ni в степенях окисления +2, +3 дают многочисленные устойчивые комплексные соединения с различными лигандами (нейтральными, органическими, неорганическими молекулами, анионами). Координационное число железа в большинстве комплексных соединений обычно равно шести, а для кобальта и никеля в соединениях катионного типа 6, анионного типа 4. Надо также отметить, что получены комплексные соединения, в которых Fe, Co и Ni проявляют формальную отрицательную степень окисления, к примеру: 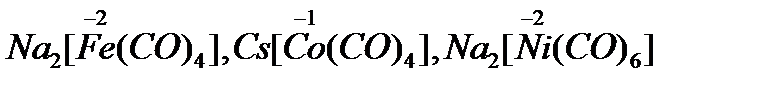 .
.
Задача 1. Предложите способы получения Fe(OH)3 и Co(OH)3.
Решение. Для получения Fe(OH)3 можно использовать общий метод получения нерастворимых в воде оснований, то есть, к раствору соли Fe(3+) нужно добавить раствор щелочи:
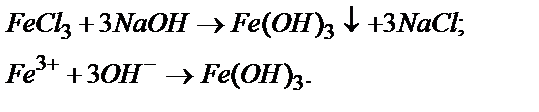
Гидроксид кобальта (3+) нельзя получить таким способом, потому что простые соли кобальта (3+) неизвестны. Единственный путь - окисление гидроксида кобальта (2+): 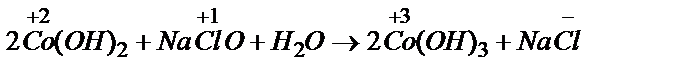 .
.
Co2+ - e ® Co3+ │ 2 восстановитель
Cl+1 +  e ® Cl- │ 1 окислитель
e ® Cl- │ 1 окислитель
Задача 2. Какие соли можно получить при сплавлении FeО, Fe2O3, FeО3 со щелочами?
Решение. Поскольку FeО - основный, Fe2O3 - амфотерный, FeО3 - кислотный оксиды, то со щелочами взаимодействует два последних с образованием феррита и феррата соответственно:
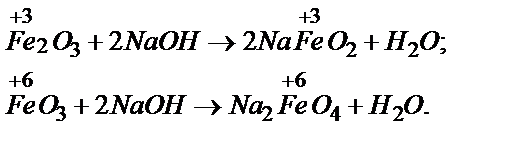
Задача 3. Составьте формулы комплексных ионов, которые можно получить из следующих частей: Fe3+, Co2+, CN-, NH3.
Решение. Из приведенных ионов комплексообразователями могут выступать: Fe3+, Co2+, лигандами - CN- и NH3. С учетом этого можно составить, например, формулы следующих комплексных ионов: [Fe(CN)6]3-, [Fe(NH3)6]2+, [Co(CN)4]2-, [Co(NH3)6]2+.
Дата добавления: 2016-02-27; просмотров: 2258;
