Получение кислорода О2 и серы S
а) В широкую пробирку или цилиндр наливают ≈5 мл пероксида Н2О2 (30%) и добавляют несколько кристаллов катализатора МnО2 или КМnO4 (осторожно, добавлять небольшими порциями!). Наблюдают бурную реакцию диспрорциинирования Н2О2. Выделение О2 контролируют с помощью тлеющей лучинки, которая загорается в атмосфере О2.
б) Для получения О2 в пробирку насыпают ≈1г КMnO4 и сильно прокаливают в пламени горелки. Выделение О2 контролируют, как и в предыдущем опыте. После охлаждения пробирки добавляют в нее 4-5 мл воды, перемешивают. Наблюдают образование зеленого раствора К2MnO4 и бурого осадка MnO2.
в) Получить серу можно несколькими способами. В пробирку наливают 2-3 мл раствора Na2SO3, подкисляют раствором H2SO4, добавляют раствор Na2S2O3 или Na2S. Сера образуется в обоих случаях в виде белёсого осадка.
Опыт 2. Окислительно-восстановительные свойства пероксида водорода
а) К 2 мл соли Рb2+ добавляют раствор Na2S, при этом образуется черный осадок РbS. Для лучшего осаждения его подогревают, после чего сливают с осадка раствор и добавляют ≈3мл 3% -ного раствора H2O2. Образуется белый осадок PbSO4. Записать уравнения реакций.
б) В 2 мл соли Cr3+ добавляют по каплям раствор щелочи. Сначала выпадает осадок Cr (ОН)3, который растворяется в избытке КОН, с образованием комплекса [Cr(ОН)4]- зеленого цвета. К нему добавляют раствор Н2О2 и подогревают до перехода зеленого цвета в желтый (K2CrO4). Записать уравнения соответствующих реакций.
в) В пробирку наливают раствор KMnO4, подкисляют его и добавляют раствор H2O2. Наблюдают обесцвечивание раствора и выделения О2.
Опыт 3. Окислительные свойства серы (выполняют в шкафу)
В пробирке смешивают 1,7 г порошка Fe и 1 г порошка S. Закрепляют в штативе вертикально и сильно прогревают пламенем горелки (осторожно, реакция сильно экзотермическая!). Записывают наблюдения.
Опыт 4. Получение сульфидов металлов
К растворам солей Zn2+, Mn2+, Cd2+, Pb2+, Cu2+, Ni2+, добавляют 2-3 капли раствора Na2S. Отмечают цвет образовавшихся осадков.
Опыт 5. Восстановительные свойства сульфидов
В одну пробирку наливают раствор KMnO4, в другую - раствор K2Cr2O7, подкисляют оба раствора и добавляют несколько капель раствора Na2S. Записывают наблюдение и уравнение соответствующих реакций.
Опыт 6. Получение SO2 (выполняется в вытяжном шкафу)
В пробирку насыпают небольшое количество порошка Na2SO3 и каплями добавляют разбавленный раствор HCl. Наблюдают выделение газа, который испытывают влажной синей лакмусовой бумажкой.
Опыт 7. Окислительно-восстановительная двойственность сульфитов
а) В две пробирки наливают раствор Na2SO3, подкисляют его и добавляют несколько капель растворов Na2S - в первую пробирку и раствор KMnO4 - во вторую. Записывают наблюдения, составляют уравнения реакций и рассчитывают Э.Д.С.
б) На подкисленный раствор Na2SO3 в четырех пробирках действуют растворами Br2, I2, KMnO4, K2Cr2O7. Записывают наблюдения, составляют уравнения соответствующих реакций и подсчитывают Э.Д.С. для каждой реакции.
Опыт 8. Восстановительные свойства тиосульфата натрия Na2SO3
В четыре пробирки наливают отдельно раствор Cl2 (хлорной воды), растворы KMnO4, K2Cr2O7 и I2 (йодной воды). Растворы KMnO4 и K2Cr2O7 подкисляют H2SO4. По каплям добавляют в каждую пробирку раствор тиосульфата Na2S2O3. Наблюдают изменение окраски растворов, составляют уравнение каждой реакции, имея в виду, что сильными окислителями (первые три пробирки) тиосульфат окисляется до NaHSO4, а более слабыми (I2) - до тетратионатa Na2S4O6.
Свойства неметаллов VА группы (N, P, As, Sb)
Элементы VА группы относятся к p-электронных аналогов (валентными электронами является ns2np3), но типичными неметаллами является лишь азот и фосфор. Арсен (мышьяк), сурьма - металлоиды (т.е. "подобные металлов"), а висмут проявляет преимущественно металлические свойства. Распределение электронов по квантовым ячейкам:
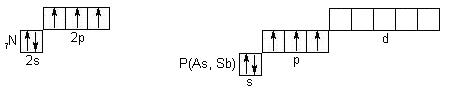
В обоих элементах на p-орбиталях расположены по 3 неспаренных электрона, то есть, для обоих элементов принципиально возможные степени окисления от -3 до +5. Но свойства азота резко отличаются от свойств фосфора. Для достижения завершенного октета азот принимает на 2p-орбиталь электроны с образованием нитридов (Li3N, Na3N), соединений с двухэлектронными связями (NH3, N2, NF3), амидов (NaNH2), имидов (Na2NH). В некоторых случаях отсутствует завершенный октет (NО, NО2), неспаренный электрон делокализуется по всей системе связей молекулы.
Наконец, в отличие от фосфора, мышьяка и сурьмы, для азота характерно pπ-pπ-взаимодействие, то есть, азот образует двойные и тройные связи, например, в азидоводородной кислоте HN3, нитрилах:
Н-N=N≡N CH3-C≡N
Формальные степени окисления азота:
-3 -2 -1 +1 +2 +3 +4 +5
NH3 N2H4 NH2OH N2O NO N2O3 NO2 N2O5
Молекулярный азот N2 химически мало активен, что обусловлено наличием тройной связи между атомами азота: N≡N (ΔH0298 = 945кДж / моль). Но при высоких температурах азот окисляет металлы и неметаллы с образованием нитридов:
3Mg + N2 = Mg3N2; 2B + N2 = 2BN
Следует внимательно рассмотреть свойства соединений азота с различными степенями окисления, обратив особое внимание на их окислительно-восстановительные свойства. Для азота +3 и +5 существуют кислоты HNO2 (слабая) и HNO3 (сильная) соответственно. Нитритная (азотистая) кислота и ее соли проявляют окислительно-восстановительную двойственность. Азотная кислота HNO3 - сильный окислитель, окисляет большинство металлов и неметаллов. Смеси HNO3 и HCl и особенно HNO3 с HF окисляют даже Au, Pt, Nb, Zb и другие металлы.
Как отмечалось, для фосфора (как и для других элементов VА группы) pπ-pπ-взаимодействие нехарактерна. Наиболее распространены соединения, в которых фосфор проявляет степень окисления: -3 (PH3), -1 (Na[PO2H2]); +3 (PCl3, P2O3, H3PO3) и +5 (P2O5, H3PO4, PCl5). Элементарный фосфор существует в различных модификациях (черный, красный, белый). Химически активная белая модификация. Фосфор (Р0) проявляет свойства как окислителя (P + 3Na = Na3P), так и восстановителя (2P + 3Cl2 = 2PCl3). В степени окисления +1 фосфор представлен фосфиновой кислотой и ее солями - фосфинатами или гипофосфинатами. Фосфинаты используют в процессе химического никелирования:
Ni2+ + [PO+12H2]- + 2H2O = Ni0 + P+5O3-4 + 4H+ + H20
Оксиды фосфора (P2O3 P2O5) является андигридамы кислот - фосфоновой H2[P+3O3H] и фосфатной (H3P+5O4 - ортофосфорной, HP+5O3 - метафосфорной, H2P2O7 - пирофосфорной). Известны полифосфатные кислоты Hn+2PnO3n+1 , соли которых называют полифосфатами.
Наиболее характерными степенями окисления для мышьяка (арсена) и сурьмы (стибия) являются +3 +5. Водородные соединения AsH3 и SbH3 менее устойчивы, чем аналогичные соединения фосфора и азота - фосфин PH3 и аммиак NH3. Оксиды As2O3 (Sb2O3) и As2O5 (Sb2O5) представляют собой андигриды кислот. Оба элемента и некоторые их соединения проявляют полупроводниковые свойства.
Задача 1. Каким образом можно отличить раствор хлорида аммония от раствора хлорида натрия?
Решение. Хлорид аммония NH4Cl образован взаимодействием слабого основания NH4OH с сильной кислотой, поэтому в растворе он гидролизуется по схеме:
NH4Cl + HOH = NH4OH + HCl
NH4+ + HOH = NH4OH + H+ (pH<7)
То есть, в растворе NH4Cl - кислая среда, универсальная индикаторная бумажка изменит окраску от желтой до краснй. Хлорид натрия гидролизу не подлежит. Кроме того, раствор NH4Cl легко отличить от раствора NaCl по реакции со щелочами (при нагревании):
NH4Cl + NaOH → NH3↑ + H2O + NaCl
Аммиак определяют по запаху, а также лакмусовой или индикаторной бумагой. При прокаливании образца хлорида аммония образуются летучие соединения:
NH4Cl → NH3 ↑ + HCl ↑
Хлорид натрия при прокаливании не разлагается. Окраска пламени при внесении в него NaCl - желтая, а солей аммония - бесцветная.
Задача 2. Гидроксиламин NH2OH - сильный восстановитель, но он может обнаруживать и свойства окислителя. Напишите восстановительные реакции, подтверждающие окислительно-восстановительную двойственность гидроксиламина.
Решение.
а) 2 NH2OH + І02 + 2KOH → N02 + 2KІ-1 + 4 H2O
восстановитель
б) 2NH2OH + 4Fe+2SO4 + 3H2SO4 → 2Fe2(SO4 )3 + (NH4)2SO4 + 2H2O
окислитель
Задача 3. При сгорании 3г фосфора образовалось 6,87г оксида, плотность пара которого относительно воздуха 9,8. Какой оксид образовался?
Решение. По условию задачи образовалось 6,87 г оксида, то есть, в реакцию вступило 3,87г О2. Находим отношение х:у в формуле оксида PxOy:
х : y = 3/31 : 3,87/16 = 0,0968 : 0,242 = 2 : 5
Формула оксида P2O5; для него молекулярная масса составляет 2 ·31 + 5 ·16 = 142 г / моль. Истинная молекулярная масса составляет М = 9,8·dвозд.= 9,8·29 = 284,2 г/моль . Таким образом, формула оксида P4O10.
Получение азота
В пробирку насыпают 2 г нитрита натрия NaNO2, добавляют 4-5 мл насыщенного раствора NH4Cl. Закрывают пробирку пробкой с газоотводной трубкой, закрепляют в штативе с лапкой горизонтально и осторожно прогревают смесь реагентов. Через 1-2 минуты собирают газ в широкую пробирку под водой в кристаллизаторе. Через некоторое время закрывают пробирку, вынимают из ванны и проверяют наличие N2 горящей лучиной и известковой водой (пламя гаснет, а известковая вода не меняется). Написать уравнения происходящих реакций.
Опыт 2. Получение аммиака
Сухую смесь NH4Cl и Ca(OH)2 (1: 1) насыпают в пробирку с газоотводной трубкой, закрепляют пробирку горизонтально в штативе и нагревают ее медленно до выделения NH3. Выделение NH3 проверяют по характерному запаху, индикаторной или фенолфталеиновой бумажкой.
Опыт 3. Взаимодействие аммиака с кислотами
Смачивают одну стеклянную палочку концентрированным раствором NH3 в воде, а вторую концентрированным раствором HCl и подносят одну палочку к другой. Появляется белый дым хлорида аммония.
Опыт 4. Термический распад солей аммония
Нагревают в фарфоровых тиглях на пламени горелки небольшое количество аммонийных солей: HN4Cl, NН4NO3, (NН4)2SO4 до полного их разложения. Записывают уравнения соответствующих реакций.
Опыт 5. Окислительно-восстановительные свойства гидразина и гидроксиламина
а) В две пробирки наливают по 2-3 мл йодной воды, добавляют небольшое количество раствора KOH или NaOH. В первую пробирку добавляют несколько кристаллов сульфата или хлорида гидразина, а во вторую - гидроксиламина. Перемешивают смесь до обесцвечивания раствора.
б) В две пробирки наливают небольшое количество (2 мл) раствора FeSO4, добавляют несколько кристаллов сульфата или хлорида гидразина, а во вторую - кристаллов гидроксиламина, перемешивают. Окисление Fe(2+) до Fe(3+) проверяют, добавив в каждую пробирку 1-2 капли роданида; при этом раствор окрашивается в темно-красный цвет комплекса [Fe(SCN)3]. Записывают уравнения реакций всех опытов.
Опыт 6. Окислительно-восстановительные свойства нитрита натрия
В одну пробирку наливают раствор KI, а во вторую - KMnO4, подкисляют серной кислотой и добавляют 1-2 мл нитрита натрия (или несколько кристаллов сухого NaNO2). Наблюдают изменение окраски растворов. Записывают уравнения реакций.
Опыт 7. Получение оксидов NO и NO2 (вытяжной шкаф!)
В 2 пробирки помещают небольшое количество медной стружки или проволоки. Добавляют в первую пробирку разбавленной азотной кислоты HNO3, а во вторую - концентрированной. Первую пробирку слегка подогревают. Наблюдают появление голубого раствора соли Cu2+ и выделение бесцветного газа NO в первой пробирке и бурого газа NO2 - во второй, записывают уравнения реакций.
Опыт 8. Гидролиз фосфатов
В три пробирки наливают растворы Na3PO4, NaH2PO4, Na2HPO4 и испытывают растворы лакмусовой и универсальной индикаторной бумажками (можно раствором универсального индикатора). Написать уравнение реакции гидролиза Na3PO4. Найти по таблице константу диссоциации H3PO4 (К1, К2, К3) и сделать вывод, на какой стадии гидролиз практически останавливается.
Опыт 9. Растворимость фосфатов, качественные реакции на ионы фосфорной кислоты
а) В растворы солей Ca2+, Mg2+, Pb2+ и Ag+ добавляют по каплям раствор Na3PO4. наблюдают образование осадков, отмечают их цвет.
б) К 2-3 мл раствора молибдата аммония, подкисленного раствором HNO3, добавляют несколько капель фосфорной кислоты H3PO4 или ее соли. Смесь нагревают. Образуется осадок фосфоромолибдата аммония:
HNO3 +12 (NH4)2 MoO4+21 HNO3→(NH4)3H4[P(Mo2O7)6]↓+21 NH4NO3+10H2O .
Свойства неметаллов IVА группы (С, Sі)
В IVА группу входят 5 элементов (6С, 14Si, 32Ge, 50Sn, 82Pb) с электронной формуле ns2np2. Углерод (карбон) и кремний - типичные элементы, неметаллы; германий, олово и свинец составляют подгруппу германия, это - металлы (германий лучше отнести к металлоидам, то есть, металлоподобным элементам). Несмотря на то, что количество валентных электронов у углерода и кремния одинакова, по своим свойствам они четко отличаются друг от друга.
В зависимости от числа σ-связей координационное число углерода равно четырем (sp3-гибридизация: алмаз, CH4, CCl4), трем (sp2-гибридизация: графит, бензол, CO32-) или двум (sp-гибридизация: карбин, CO2 CS2). В неорганических соединениях углерод проявляет степени окисления -4 (Al4C3), +2 (CO), +4 (CO2). Кремний в соединениях проявляет степень окисления -4, (+2) и +4. Для углерода характерно образование соединений с двойными (С = С) и тройными (С 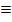 С) связями за счет рπ-рπ-взаимодействия; для кремния pπ-pπ-взаимодействие не происходит. Углерод проявляет способность к образованию гомоцепных молекул со связями С-С линейного, разветвленного, циклического типов (эти многочисленные соединения изучает органическая химия). Для кремния образования цепей ... Si-Si ... сильно ограничено.
С) связями за счет рπ-рπ-взаимодействия; для кремния pπ-pπ-взаимодействие не происходит. Углерод проявляет способность к образованию гомоцепных молекул со связями С-С линейного, разветвленного, циклического типов (эти многочисленные соединения изучает органическая химия). Для кремния образования цепей ... Si-Si ... сильно ограничено.
Следует обратить внимание на аллотропию (модификации) простых веществ: для углерода - это графит, алмаз, карбин, фуллерены (С60, С70 и другие). Для кремния известны две модификации. При обычных температурах углерод и кремний очень инертны. При высоких температурах они реагируют со многими металлами и неметаллами, проявляя при этом, в зависимости от условий свойства окислителя или восстановителя:
2Mg + Si → Mg2Si
окислитель
Si + H2O + 2 KOH = K2SiO3 + 2H2О
восстановитель
Карбиды и силициды d-металлов - твердые жаростойкие соединения, нерастворимые в кислотах и щелочах. Карбиды и силициды активных металлов (s- и p-металлов), наоборот, реагируют с кислотами или H2O (некоторые при нагревании). При этом образуются ацетилен (ацетилениды, например, CaC2) или метан (метанид, Al4C3), а при действии кислот на силициды выделяется силан, SiH4. С водородом углерод образует многочисленные соединения – углеводороды (алканы, алкены, ароматические углеводороды), которые изучаются в органической химии. Гидрогенсиланы, или силаны, соответствуют общей формуле SinH2n+2, но в отличие от углеводородов, атомы кремния не образуют длинных цепей (максимально n = 8, то есть, до Si8Н18.) Для углерода получено оксиды СО, СО2, С3О2,С5О2,С12О9; для кремния - SiO, SiO2. Следует обратить внимание на строение и химические свойства оксидов и других соединений, в частности, карбонилов, карбонатов, силикатов, а также на применение этих соединений.
Задача1. Для получения извести используются реакция разложения карбоната кальция. Определить, при какой температуре начинается эта реакция.
Решение: Температура начала реакции определяется по формуле: T = ΔH / ΔS.
Рассчитаем для реакции: CaCO3 → CaO + CO2 значение ΔH и ΔS. Согласно следствию из закона Гесса, ΔНх.р. = (ΔНСаО + ΔНСаСО3) - ΔНСаСО3.
ΔHх.р. = (-635,1 + (-393,5)) - (-1206,0) = 177,39 кДж / моль.
Аналогично находим ΔSх.р. :
ΔSх.р. = (39,7 + 231,6) - 92.9 = 160,4 Дж/моль·K = 0,1604 кДж/моль·K.
Температура начала реакции имеет значение: T = 177,39 / 0,1604 ≈ 1106 K (≈833°C)
Задача 2: Рассчитайте pH 0,01 м раствора К2СО3.
Решение: Карбонат калия - соль, образованная сильным основанием и слабой кислотой. В водном растворе она гидролизуется по схеме:
К2 СО3 + 2HOH ↔ 2KOH + H2CO3 .
Для солей такого типа pH рассчитывают по формуле:
рН = 7 + 1/2 (pKк-ты + рСсоли).
Для H2CO3 (двухосновная кислота) К1 = 4,5·10-7 (рК =6,35), К2 = 4,7·10-11 (рК = 10,33). Так как К2 - очень малая величина, то ею можно пренебречь.
Таким образом, рН = 7 + 1/2 · (6,35 + 2) ≈ 11,2.
Задача 3. Почему при добавлении раствора соды к раствору солей алюминия выпадает белый осадок Al(ОH)3, а не карбонат алюминия.
Решение: В результате гидролиза Na2CO3 образуется NaOH (щелочная среда).
Na2CO3 + 2HOH → 2NaOH + H2CO3.
Соли алюминия также гидролизуются, но растворы Al3+ слабокислые. С другой стороны, карбонат алюминия Al2(CO3)3 - соль образованная слабым основаним и слабой кислотой; соли такого типа подлежат полному гидролизу. Итак, при взаимодействии солей алюминия с раствором Na2СO3 фактически происходит реакция:
Al3++ 3OH- → Al(OH)3 ↓
Или: 2Al3+ + 3CO32- + 6H2O → Al(OH)3↓ + 3H2CO3
Получение аморфного углерода и древесного угля (вытяжной шкаф!)
а) В стаканчик на 50 мл насыпают 20-25 г сахарной пудры, смачивают ее ≈2 мл воды и добавляют 10-12 мл концентрированной серной кислоты. Осторожно перемешивают стеклянной палочкою. Через 1-2 мин начинается энергичная экзотермичная реакция с выделением газообразных продуктов:
С12 H22 O11 + 2H2SO4 = 13H2O↑ + 2SO2↑ + 11C + CO2 ↑
б) "Сухая перегонка древесины": пробирку с газоотводной стеклянной (!) трубкой заполняют на ¾ мелко нарезанной древесиной и закрепляют горизонтально в штативе с лапкой. Закрывают пробирку с пробкой со стеклянной трубкой и равномерно прогревают пробирку небольшим пламенем, следя за преобразованием древесины. Поджигают газ, выделяющийся из трубки. После охлаждения пробирки черный продукт (уголь) собирают для выполнения следующего опыта.
Опыт 2. Восстановительные свойства угля
Древесный уголь ≈1-2 г растирают в ступке с 1-2 г CuO и переносят смесь в пробирку. Закрывают пробирку пробкой с газоотводной трубкой и закрепляют горизонтально в штативе с лапкой. Пробирку сильно нагревают; газ выделяется пропускают через насыщенный раствор Ca(OH)2. Наблюдают за превращениями, происходящими в пробирке со смесью CuO с углем и в пробирке с раствором Ca(OH)2. Написать уравнения соответствующих реакций, сделать выводы.
Опыт 3. Получение и определение свойств оксида углерода(2+) (сильная тяга !!!)
В колбу Вюрца наливают 10-15 мл концентрированной H2SO4, а в делительную воронку 5-6 мл муравьиной кислоты HCOOH. Газоотводную трубку погружают в пробирку с аммиачным раствором оксида серебра Ag2O (готовят раствор Ag2O в NH3 из раствора AgNO3, добавляя к нему по каплям концентрированный раствор NH3 до полного растворения первоначального осадка Ag2O). Из делительной воронки по каплям добавляют HCOOH к серной (сульфатной) кислоте. Через некоторое время наблюдают образование в пробирке с аммиачным раствором Ag2O металлического серебра в виде черного порошка. Написать уравнения соответствующих реакций.
Опыт 4. Получение и свойства оксида углерода(4+)
В аппарат Киппа кладут кусочки мрамора, наливают раствор HCl (1: 4) и открывают кран. Наблюдают реакцию CaCO3 с HCl.
а) Пропускают СО2, образующийся в аппарате Киппа, в насыщенный раствор (CaOH)2. Наблюдают выпадение осадка, а через некоторое время его растворение. Написать уравнения происходящих реакций.
б) Пропускают CO2 через воду, в которую предварительно добавлено несколько капель нейтрального раствора лакмуса. Наблюдают изменение окраски раствора. Пробирку с раствором CO2 в воде и лакмусом подогревают до кипения, наблюдают изменение окраски. Записать уравнения равновесия, существует в водном раствора оксида карбона (4+), найти в таблице значение константы диссоциации H2CO3 (K1 и К2).
Опыт 5. Получение карбонатов и гидрокарбонатов
В пробирку наливают 1-2 мл растворов солей металлов: Ca2+, Mg2+, Ba2+, Zn2+, Cd2+, Cu2+, Fe2+, добавляют к ним по каплям раствор Na2CO3. Наблюдают выпадение осадков карбонатов. Повторяют опыт с растворами этих же металлов, добавляя к ним раствор гидрокарбоната NaHCO3. Сравнивают результаты первого и второго опытов.
Опыт 6. Гидролиз карбонатов и силикатов
В пробирку наливают 1-2 мл растворов NaHCO3, Na2CO3, KHCO3, K2CO3, Na2SiO3 и добавляют 1-2 капли раствора универсального индикатора. Сравнивают окраску растворов шкале рН, записывают уравнения реакций гидролиза солей.
Опыт 7. Получение кремниевой кислоты
а) Гидрогель кремниевой кислоты: в пробирку наливают 1-2 мл раствора Na2SiO3, по каплям добавляют раствор HCl (1: 1), перемешивают смесь. Наблюдают образование студенистого осадка.
б) Гидрозоль кремниевой кислоты: к 2-3 мл раствора Na2SiO3 добавляют 2-3 мл концентрированной HCl. Образуется коллоидный раствор кремниевой кислоты. Подогревают его до кипения. Наблюдают происходящие изменения.
в) В раствор силиката Na2SiO3 пропускают СО2 из аппарата Киппа. Через некоторое время образуется студенистый осадок Н2SiO3. Записывают уравнение реакции. Находят в таблице значения констант диссоциации Н2СО3 и Н2SiO3, делают вывод относительно силы кислот.
Дата добавления: 2016-02-27; просмотров: 1164;
