Получение марганца разложением его оксалата
В сухую пробирку насыпают примерно 1 г оксалата марганца MnС2O4 и нагревают, изредка встряхивая пробирку. Отмечают цвет полученного порошка марганца. Составляют уравнение реакции.
В заключении укажите: к какому типу относится данная реакция?
Опыт 2. Взаимодействие хрома и марганца с кислотами
В 6 пробирок наливают кислоты: HCl, H2SO4, HNO3 концентрированные и разбавленные. В каждую из них шпателем вносят необходимое количество порошка марганца. Наблюдают выделение газов. Составляют уравнения реакций. Аналогичный опыт проводят с хромом.
В выводах укажите:
- От чего зависит продукт восстановления кислоты?
- В каком случае происходит пассивация металла?
Опыт 3. Получение гидроксидов Cr(OH)3 и Mn(OH)2 и изучение их свойств
а) к 1 мл раствора соли хрома (3+) доливают ½ мл раствора щелочи. Отмечают цвет малорастворимого гидроксида хрома. Записывают уравнение реакции. Испытывают отношения Cr(OH)3 к кислоте, избытку щелочи, раствору аммиака. Отмечают окраску растворов. Составляют уравнения реакций.
В заключении укажите:
- В каком случае Cr(OH)3 растворился? почему?
- Какой кислотно-основный характер у гидроксида хрома (3+)?
б) К 1 мл раствора соли марганца (2+) приливают равный объем NaOH. К полученному осадка гидроксида марганца (2+) добавляют 2 мл раствора Br2 - бромной воды. Отмечают цвет осадка, записывают уравнения реакции окисления-восстановления.
В заключении укажите: какие свойства Mn(OH)2 иллюстрирует данная окислительно-восстановительная реакция?
Опыт 4. Каталитические свойства оксидов Cr2O3 и MnО2
а) каталитические свойства Cr2O3 (опыт проводят под тягой!)
На керамическую чашку наносят несколько капель нефти. Поверхность капель засыпают Cr2O3. Тлеющей лучинкой прикасаются к катализатору, смешивая с нефтью. Наблюдают горения нефти без пламени.
б) каталитические свойства MnО2
В две пробирки наливают Н2О2. В одну из них добавляют шпателем небольшое количество MnО2. Затем в каждую из пробирок вносят тлеющую лучинку. Записывают уравнение реакции разложения перекиси водорода.
В заключении укажите: какую роль играет MnО2 в данной реакции?
Опыт 5. Окислительно-восстановительные свойства соединений Cr и Mn
а) восстановительные свойства солей хрома (3+)
К 1 мл соли хрома (3+) приливают избыток КОН до растворения выпадающего сначала осадка и образования K3[Cr(OH)6]. Затем добавляют несколько капель 3% раствора Н2О2. Нагревают смесь в стакане с горячей водой до перехода зеленого цвета в желтый, что указывает на образование в растворе хромата калия K2CrО4.
б) окислительные свойства хроматов
Раствор хромата калия наливают в 4 пробирки (по 1 мл) подкисляют раствором 2н. H2SO4. В первую пробирку вносят по каплям раствор сульфида натрия до изменения окраски смеси. Отмечают помутнение раствора. Во вторую пробирку добавляют йодид калия. Определяют с помощью раствора крахмала выделение свободного йода. В третью добавляют раствор сульфата железа (2+), а затем NH4SCN. Отмечают характерную окраску. В четвертую - Na2SO3 до изменения цвета раствора. Записывают уравнения всех четырех реакций, подбирая коэффициенты методом полуреакций.
В заключении укажите:
- До какой степени окисления восстанавливается хром (6+)?
- Почему полуреакции восстановления хромата калия в четырех рассмотренных выше случаях одинаковы?
в) окисление соли марганца (2+) пероксодисульфатом аммония
В пробирку до 1/3 объема наливают воду, добавляют 3-4 кристаллика (NH4)2S2O8 и 3-4 капли раствора катализатора AgNO3. Нагревают смесь до кипения и добавляют каплю раствора сульфата или нитрата (не хлорида!) марганца. Отмечают появление окраски раствора и записывают уравнение реакции (образуется марганцевая кислота).
г) окислительно-восстановительная двойственность MnО2
В пробирку помещают 1 микрошпатель оксида марганца(4+) и 2-3 капли концентрированной соляной кислоты. По запаху и цвету определяют, какой газ выделяется? Записывают уравнение реакции. В тигель кладут небольшой кусочек NaOH (пинцетом) и кристаллический нитрат калия. Тигель осторожно нагревают до расплавления смеси и добавляют минимальное количество MnО2, продолжая нагревание, пока масса не загустеет. Записывают уравнения реакций, с учетом того, что MnО2 окисляется до Na2MnО4.
В выводах укажите, в каком случае MnО2 является окислителем, а в каком - восстановителем.
Опыт 6. Получение хромовых покрытий (электролитическое хромирование) (элементы НИРС)
Установка для гальванического покрытия (рис.5) состоит из химического стакана (1), эбонитовой покрышки с тремя клеммами (2), стального катода (3), активного металлического анода (4), рубильника (5), реостата (6), амперметра (7):
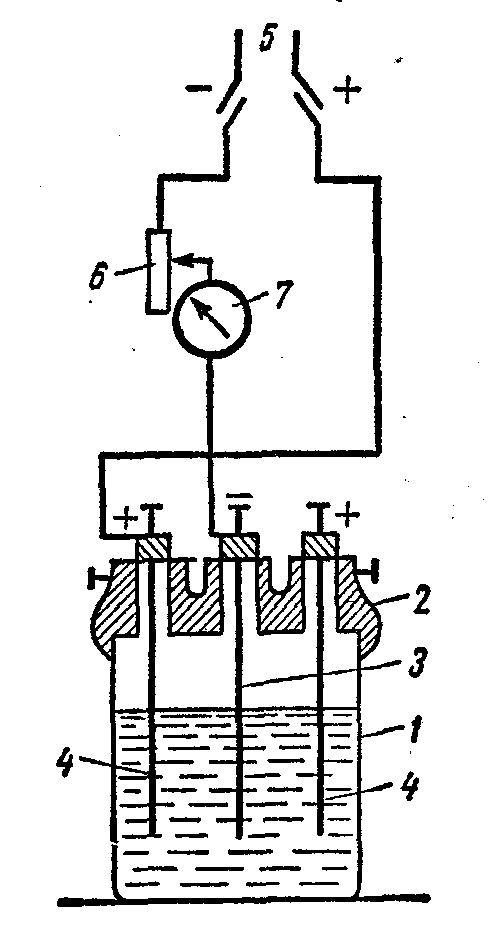
Рис.5. Схема установки для нанесения покрытий
Медную пластинку тщательно полируют мелом и промывают струей воды. Закрепляют ее в крышке электролизера и присоединяют к отрицательному полюсу источника постоянного тока (катоду), а к другой клемме (+) присоединяют свинцовую пластинку - анод. Наливают электролит: в 200 мл воды растворяют 50 г CrО3 и добавляют 10 капель 96% H2SO4. Электролизер закрывают, ставят в горячую воду (500С). По достижению необходимой температуры устанавливают сопротивление таким образом, чтобы сила тока I составляла 5A. Через 5 минут снижают I до 2,5А. Рабочее напряжение составляет 6-8 В. Электролиз проводят в течение 15-20 минут, после чего разрывают цепь и рассматривают образовавшийся слой хрома.
Свойства металлов VB группы (подгруппы ванадия)
Общая формула металлов VB группы (23V, 41Nb, 73Ta) – (n-1) d3ns2, но у элемента 41Nb наблюдается «провал» электрона, то есть, его электронная формула: d4ns1.
↑↓ ↑
23V , 73Ta ↑↑↑ 41Nb ↑↑↑↑
Максимальная положительная степень окисления равна (3 + 2) = 5 или (4 + 1) = 5;
C амая низкая степень окисления +2. Но известны многочисленные соединения металлов со степенями окисления +3 и +4. Наиболее характерные оксиды:
ЭO, Э2O3 - основные оксиды (Э = V, Nb, Ta);
ЭO2 - амфотерные оксиды;
Э2O5 - кислотные оксиды (ангидриды кислот).
Для ванадия известны многочисленные разноцветные оксиды нестехиометричного состава: серый VO (VO0.9-1.2), черный V2O3 (VO1.6-1.8), синий VO2 (VO1.8-2.17), красный V2O5. Стандартные электродные потенциалы металлов VB группы (Me0 - zē → Mez+) (E, B):
Me = V (-1,19; z = 2); Nb (-1,10; z = 3); Ta (-1,13; z = 5).
При обычных температурах в компактном виде ванадий, ниобий и тантал инертны: только ванадий медленно растворяется в плавиковой кислоте (HF) и концентрированной HNO3 , образуя соединения ванадия (+5): 3V+5HNO3 → 3HNO3+5NO+H2O.
Ниобий и тантал растворяются в смеси HNO3 и HCl («царская водка»), или, лучше, в смеси HNO3 и HF:
3Nb + 5HNO3 + 21HF=3H2[NbF7] + 5NO + 10H2O.
В состоянии порошков ванадий, ниобий и тантал реагируют при высоких температурах с большинством окислителей (О2, S, Se, галогены) с образованием соединений Ме(+5). Порошки V, Nb i Ta адсорбируют водород, образуя твердые растворы смешанного состава.
При обычных условиях наиболее характерны степени окисления +4 и +5, например, МеHal5, MeO2Hal, MeOHal3 , MeOHal2 (Hal - галоген). В водных растворах указанные соединения гидролизуются. Следует внимательно рассмотреть по учебнику свойства соединений ванадия +2, +3, +4 и +5, обратив особое внимание на склонность V(+4) и V(+5) к реакции полимеризации с образованием изо- и гетерополиванадатов: V2О74- , V6О174- , НV6О173- , V10О286- - и другие. Степень полимеризации зависит от рН и концентрации ионов ванадия в растворе. В нейтральной и щелочной средах ванадий (+5) существует в виде мономерного ванадат-иона VО3-.
Следует обратить внимание на производство металлов VВ группы и применение их в технике и промышленности (производство сплавов, электронная промышленность, производство стекла и керамики и т.д.).
Задача1. Какая из двух солей: VCl2 или VCl5 подлежат большему гидролизу и почему?
Решение. Дихлород ванадия VCl2 имеет ионный тип связи, поэтому такие соли гидролизуются преимущественно по первой степени и образуют прозрачные растворы:
VCl2 + HOH ↔ V(OH)Cl + HCl
Пентахлорид VCl5 - молекула с ковалентной типом связи. Будучи кислотными соединениями, соли такого типа подлежат значительно большему гидролизу. Итак, VCl5 при взаимодействии с водой сильно гидролизуется с образованием амофорного осадка гидратированного оксида:
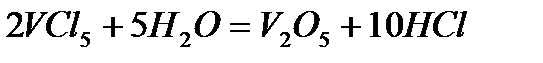
Задача 2. Как взаимодействует ванадил сульфат с рас творами KMnO4 и K2Cr2O7? Составьте уравнения электронно-ионного баланса.
Решение. Ванадил сульфат 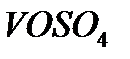 с сильными окислителями проявляет восстановительные свойства:
с сильными окислителями проявляет восстановительные свойства: 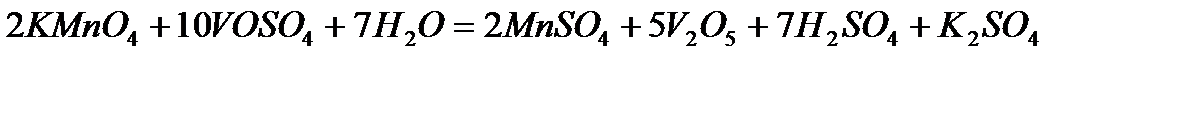
а) 

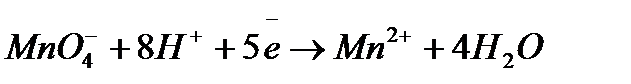 2
2
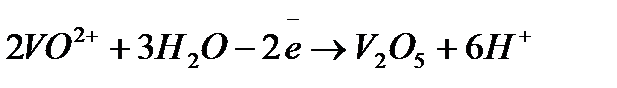 5
5
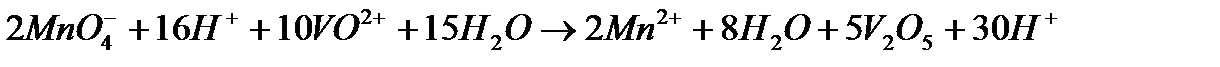
Или после сокращения 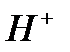 и
и 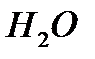 :
:
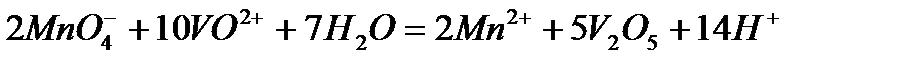
б) 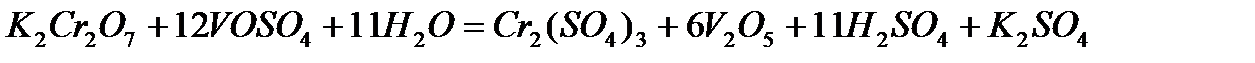
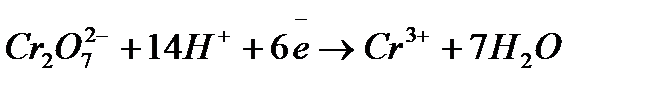
 1
1
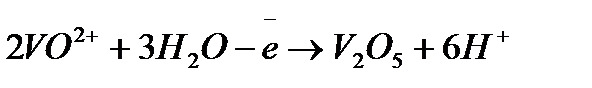 6
6
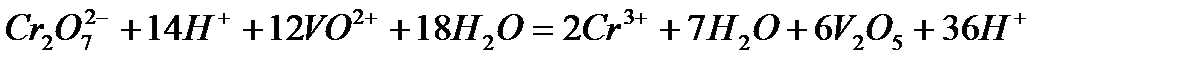
После сокращения 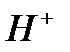 и
и 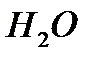 суммарное ионное уравнение имеет вид:
суммарное ионное уравнение имеет вид:
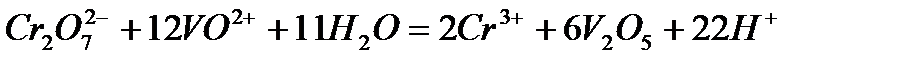
Дата добавления: 2016-02-27; просмотров: 1877;
