Взаимодействие олова и свинца с растворами кислот и щелочей
а) действие на Sn и Pb разбавленных кислот
В три пробирки кладут по небольшой грануле металлического олова, еще в три пробирки помещают столько же свинца. Исследуют воздействие на эти металлы кислот: 2н. HCl, HNO3, H2SO4, добавляя их по 1 - 2 мл в каждую пару пробирок. Отмечают медленное взаимодействие компонентов на холоде. Осторожно нагревают пробирки, наблюдая выделение газообразных продуктов. Записывают уравнения реакций.
В заключении укажите: почему во всех пробирках происходит растворение свинца?
б) действие на олово и свинец растворов концентрированных кислот
Проводят по методике, описанной в опыте 1а. (Опыты выполняются под тягой!)
В заключении укажите: влияет на характер реакции концентрация соляной кислоты?
в) действие растворов щелочей
В две пробирки наливают по 1-2 мл раствора NaOH и вносят в одну пробирку - гранулу олова, а в другую - гранулу свинца. Нагревают пробирки. Составляют уравнения реакций, учитывая, что Sn2+ и Pb2+ образуют при этом гидроксокомплексы.
В заключении укажите: почему олово и свинец в отличие от железа, никеля и других металлов растворяются в щелочах?
Опыт 2. Получение гидроксидов и изучение их свойств
В две пробирки наливают 1-2 мл раствора хлорида олова (2+). В каждую пробирку прибавляют по каплям раствор NaOH до образования осадка гидроксида. К полученному гидроксиду добавляют: в первую пробирку несколько капель кислоты 2н. HNO3, а в другую - столько же 2н. NaOH. Растворы встряхивают, добиваясь растворения в обоих случаях.
Аналогичный опыт проводят с солью свинца (2+). Записывают уравнения реакций получения нерастворимых гидроксидов и их растворения в кислоте и щелочи, учитывая, что в щелочной среде образуются комплексные анионы [Sn(OH)4]2- и [Pb(OH)4]2- .
В заключении укажите:
- В виде каких ионов находятся Pb2+ и Sn2+ в кислой и щелочной среде?
- Почему при растворении Pb(OH)2 надо использовать азотную или концентрированную уксусную кислоту, а не соляную или серную?
Опыт 3. Окислительно-восстановительные свойства соединений олова и свинца
3.1. Восстановительные свойства олова (2+)
а) В две пробирки наливают немного раствора хлорида олова (2+). В первую добавляют 1 мл 2н. раствора HCl и 2 мл перманганата калия, во вторую 1 мл 2н. раствора HCl и 2 мл дихромата калия. Наблюдают в обоих случаях изменение цвета исходных растворов. Записывают окислительно-восстановительные реакции, подбирают коэффициенты с помощью ионно-электронного метода, учитывая то, что в кислой среде MnО4- восстанавливается до Мn2+, а Cr2O72- - до иона Cr3+.
б) В пробирку с раствором нитрата висмута добавляют по каплям раствор NaOH до образования осадка. В другой пробирке действием щелочи на раствор SnCl2 получают Na2[Sn(OH)4]. Выливают раствор из второй пробирки в первую и наблюдают образование черного осадка металлического висмута. Составляют уравнения реакций.
3.2. Окисление Pb2+ до Pb4+
В пробирку с раствором ацетата свинца (CH3COO)2Pb добавляют равный объем раствора хлорной извести CaOCl2. Смесь нагревают и наблюдают образование черно-бурого осадка PbО2. Составляют уравнение реакции.
В заключении укажите: какие окислительно-восстановительные свойства проявляют соединения Pb(2+) и Sn(2+)?
3.3. Окислительные свойства PbО2
В пробирку с раствором HNO3 добавляют немного раствора KI и несколько крупинок PbО2. Пробирку слегка подогревают и наблюдают побурение раствора. Опытным путем устанавливают, что в растворе образовался йод. Составляют уравнение реакции.
Опыт 4. Гидролиз солей Pb2+ и Sn2+
В две пробирки наливают по 1 мл Н2О и добавляют немного кристаллических SnCl2 в первую и PbCl2 - во вторую. Реакционную смесь размешивают стеклянной палочкой и опускают в раствор бумажку универсального индикатора. Отмечают рН растворов. В первую пробирку добавляют еще 5-6 капель воды, отмечают образование осадка гидроксохлорида олова (2+) SnOHCl. Вторую пробирку нагревают и добавляют в нее такой же раствор Na2CO3. Наблюдают выпадение осадка PbCO3·Pb(OH)2.
В выводах укажите:
- Почему соли Sn2+ и Pb2+ подвергаются гидролизу?
- Добавлением какого реактива можно уменьшить гидролиз этих солей?
Опыт 5. Синтез PbО2 (с элементами НИРС)
3 г ацетата свинца растворяют в 20 мл 2н. уксусной кислоты. Взвешивают на весах 2,5 г хлорной извести и готовят из него насыщенный раствор. Для этого навеску CaOCl2 тщательно растирают в ступке с 5 мл воды, добавляют еще 10 мл воды, размешивают и фильтруют через гладкий фильтр в химический стакан. Раствор ацетата свинца нагревают до 500С и при помешивании добавляют к раствору CaOCl2. Реакция протекает по уравнению:
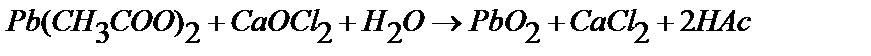 .
.
После этого реакционную смесь кипятят 10-15 минут до выпадения осадка. После охлаждения осадок PbО2 фильтруют и промывают 2-3 раза водой на воронке Бюхнера. Затем осадок вместе с фильтром сушат в сушильном шкафу при 1000С. Полученный PbО2 взвешивают, рассчитывают выход (%) по Pb(Ac)2.
Опыт 6. Электролитическое лужение (с элементами НИРС)
Собирают установку, как указано на рис.5. В электролизер наливают раствор следующего состава: 7 мл концентрированной HCl, 18 г SnCl2·2Н2О, 8 г NH4Cl, 1 л Н2О. Медные электроды зачищают наждачной бумагой, промывают водой и протирают фильтровальной бумагой и взвешивают, не касаясь пальцами поверхности. Электроды закрепляют в крышке электролизера клеммами на небольшом расстоянии друг от друга и на 2/3 погружают в раствор. Включают ток и с помощью реостата регулируют его: I = 0,2-0,25; U = 2,2B. Электролиз проводят, примерно, 1 - 1,5 часа. Затем, отключив цепь, вынимают катод из раствора, промывают водой, высушивают, измеряют площадь луженой поверхности и снова взвешивают. Зная силу тока, время электролиза, массу катода до и после выделения на нем олова, рассчитывают толщину покрытия (плотность олова 5,85 г/см3). Определяют выход металла по току.
Дата добавления: 2016-02-27; просмотров: 5057;
