Свойства р-металлов IV группы - Sn, Pb
Олово и свинец относят к семейству р-элементов, общая электронная формула: ns2np2, где n - номер периода. Итак, для этих металлов: Sn -5s25p2, для Pb -6s26p2. Практически для всех s, p-элементов возможные степени окисления могут быть определены на основании распределения валентных электронов по квантовым ячейкам в нормальном и возбужденном состоянии. Для элементов подгруппы Ge:

 в нормальном состоянии в возбужденном состоянии
в нормальном состоянии в возбужденном состоянии
2 валентных электрона 4 валентных электрона
Таким образом, олово и свинец в соединениях могут проявлять степени окисления 0; +2; +4. В водородных соединениях - SnH4 и PbH4 – металлы проявляют отрицательную степень окисления -4.
При определении кислотно-основных свойств оксидов и гидроксидов олова и свинца в степенях окисления +2 и +4 необходимо помнить, что они являются промежуточными металлами V и VI периодов, следовательно, их оксиды и гидроксиды в этих степенях окисления амфотерные.
ослабление кислотных свойств
SnO PbO SnO2 PbO2
Sn(OH)2 Pb(OH)2 H2SnO3 H2PbO3
усиление основных свойств
Вследствие амфотерности гидроксидов Sn(OH)2 и Pb(OH)2 металлы олово и свинец легко растворяются в водных растворах щелочей с образованием водорода и комплексной соли: 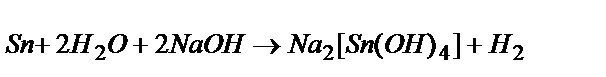 .
.
Взаимодействие этих металлов с разбавленными кислотами сопровождается окислением олова и свинца до степени окисления +2 с образованием соответствующих солей. Реакции протекают при нагревании. Все эти реакции гетерогенные, поэтому непременным условием их протекания является растворимость образующихся солей. Из трех солей PbCl2, PbSO4, Pb(NO3)2 хорошо растворимый только нитрат, поэтому свинец лучше растворяется в HNO3:
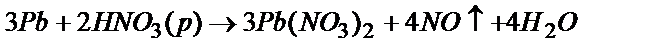
 -2e® Pb2+ 3
-2e® Pb2+ 3
NO3- +4H+ +3e® 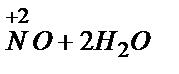 2
2
При взаимодействии с концентрированными кислотами свинец во всех случаях окисляется до Pb(2+), и образует с концентрированной H2SO4 кислую соль - Pb(HSO4)2. C концентрированными серной и азотной кислотами олово окисляется до степени окисления +4. Причем, при взаимодействии с концентрированной азотной кислотой образуется не соль, а b-оловянная кислота, нерастворимая ни в кислотах, ни в щелочах.
Окислительно-восстановительные свойства соединений Sn и Pb обусловлены различной стойкостью их соединений в разных степенях окисления. В степени окисления +4 они могут быть только окислителями (поскольку степень окисления +4 максимальна). Это свойство наиболее ярко выражено у соединений Pb+4, потому что для свинца более стойкие соединения в степени окисления +2. В степени окисления +2 соединения этих элементов проявляют как окислительные, так и восстановительные свойства, однако более характерный переход Sn2+ - 2e® Sn+4, то есть, проявление соединениями Sn(+2) восстановительных свойств. Благодаря наличию вакантных d-орбиталей, эти металлы образуют многочисленные тетраэдрические и октаэдрические комплексы, например, гидроксокомплексы Na2[Sn(OH)4], Na2[Sn(OH)6], K4[Pb(OH)6].
Задача 1. Рассчитайте, хватит ли 20 г олова, содержащего 5% примесей, для получения 2,24 л Н2 (н.у.) в реакции олова с HCl?
Решение. Рассчитаем, сколько в образце олова действующего вещества:
20 - 20∙0,05 = 19 г. Используя закон эквивалентов, вычислим, сколько необходимо металла для получения указанного объема Н2:
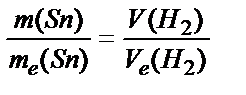 , тогда
, тогда 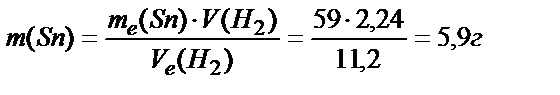 .
.
Для получения 2,24 л Н2 необходимо 5,9 г Sn , что на 13,1 г меньше, чем дано по условию. Ответ: хватит.
Задача 2. Определите тепловой эффект реакции, используя значения стандартных энтальпий образования: 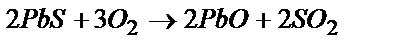 .
.
Решение. Согласно следствию из закона Гесса: ΔН0х.р. = ΣΔНºпрод - ΣΔНºисх .
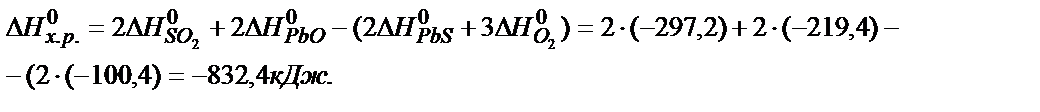
Задача 3. Пользуясь таблицей стандартных окислительно-восстановительных потенциалов, определить продукты и возможность протекания реакций при стандартных условиях: а) 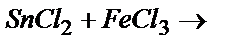 ; б)
; б) 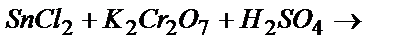 .
.
Решение. а) Вследствие большей устойчивости Sn(4+) в данной реакции Sn2+ является восстановителем: Sn2+-2  ® Sn4+, E0=-0,15B, следовательно, Fe3+ - окислитель:
® Sn4+, E0=-0,15B, следовательно, Fe3+ - окислитель:
Fe3++  ®Fe2+, E0=0,771B.
®Fe2+, E0=0,771B.
Э.Д.С. = Е0ок.– Е0восст. = 0,771 + 0,15 = 0,921В.
Реакция идет самопроизвольно в прямом направлении:
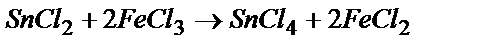
Sn2+ - 2 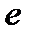 ® Sn4+ 1
® Sn4+ 1
Fe3+ + е ® Fe2 2
Sn2+ +2Fe3+ = Sn4+ + 2Fe2+
б) Sn2+ - восстановитель:  ;
;
K2Cr2O7 - окислитель: 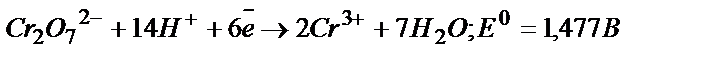 .
.
Э.Д.С. = 1,477 + 0,15 = 1,627 В. Реакция идет самопроизвольно.
Уравнение реакции выглядит так:
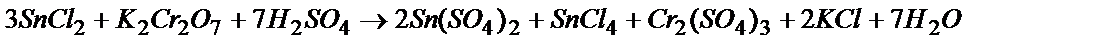
Cr2O72- + 14H+ +6 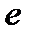 ® 2Cr3+ + 7H2O 1
® 2Cr3+ + 7H2O 1
Sn2+ -2е® Sn4+ 3
3Sn2+ + Cr2O72- + 14H+ = 3Sn4+ + 2Cr3+ + 7H2O
Дата добавления: 2016-02-27; просмотров: 5246;
