Свойства конструкционных металлов IB и IIB групп
Среди рассмотренных металлов к конструкционным можно отнести только медь, цинк и кадмий, хотя в электронной промышленности и технике широко используются также серебро, золото (IB подгруппа) и ртуть (IIB подгруппа). Стоит обратить внимание на различия в электронной конфигурации металлов подгруппы меди и подгруппы цинка. В атоме меди (3d104s1) d-подуровень считается завершенным, но он нестабилен и может отдавать один или несколько электронов:

то есть, для меди возможные положительные степени окисления: +1, +2 и +3. Для атомов подгруппы цинка последний d-подуровень стабилен: электроны подуровня d10 не отрываются. Поскольку валентными электронами являются внешние (s2), то эти элементы в соединениях всегда двухвалентные:

Электродные потенциалы металлов также резко отличаются: для меди электродный потенциал равен + 0,34В, то есть медь нерастворима в разбавленных серной, соляной, уксусной кислотах, тогда как цинк и кадмий (Е0 равны -0,76 и -0,40В соответственно) вытесняют водород из указанных кислот. В концентрированной серной кислоте и в азотной кислоте любой концентрации все три металлы (Cu, Zn, Cd) хорошо растворимы, но восстанавливают Н2SO4 и HNO3 до различных соединений.
Следует отметить еще некоторые отличия в свойствах Cu, Zn и Cd и их соединений. Цинк легко растворим в водных растворах щелочей, а медь и кадмий со щелочью не взаимодействуют. Гидроксиды цинка и меди - амфотерные (гидроксид меди растворим в концентрированных щелочах с образованием купратов), а гидроксид кадмия в щелочах нерастворим. С другой стороны, гидроксиды всех трех элементов хорошо растворимы в водном растворе NH3 с образованием аммиакатов одинакового состава [Me(NH3)4]2+.
Для всех рассмотренных металлов характерно образование многочисленных комплексных соединений с неорганическими и органическими лигандами.
Задача 1. При прокаливании 1,56 г смеси ZnCO3 и Zn образовалось 1,34 г ZnО. Вычислить состав исходной смеси (в процентах и по массе).
Решение. При прокаливании указанной смеси происходит реакция:
ZnCO3 ® ZnО + СО2. По массе СО2 (mсмеси – mZnО) находим массу ZnCO3: 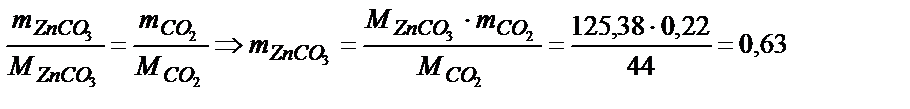 г.
г.
тогда mZnО = mсмеси - m  = 1,56 – 0,63 = 0,93 г.
= 1,56 – 0,63 = 0,93 г.
Находим процентный состав смеси:
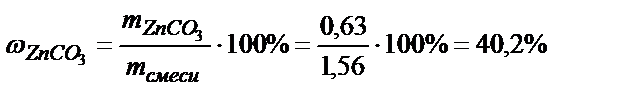 ;
;
 = 100% -40,2% = 59,8%.
= 100% -40,2% = 59,8%.
Задача 2. Найти количество теплоты, поглощаемой при восстановлении 1 кг оксида Zn графитом.
Решение. Реакция восстановления ZnО протекает в соответствии уравнению:
ZnО + С ® Zn + СО.
Используя следствие из закона Гесса, получаем: DН0298 = DН0СО - DН0ZnО = -110,5 + 350,6 = 240,1 кдж/моль. Найдем число молей ZnО, содержащиеся в 1кг: 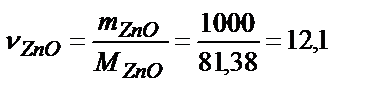 моль. Тогда DН0х.р. = 12,1×240,1 = 2705,2 кДж
моль. Тогда DН0х.р. = 12,1×240,1 = 2705,2 кДж
Задача 3. Какие процессы происходят при электролизе растворов сульфата меди: а) анод медный; б) анод платиновый (инертный)?
Решение. В растворе данной соли содержатся катионы Сu2+ и сульфат анионы SO42-
В случае а) на катоде: К (-) Cu2+ + 2e ® Cu0 (происходит восстановление меди, поскольку Е  > E
> E  ),
),
а на аноде: А(+) Cu0 –2е ® Cu2+ (происходит окисление материала анода, поскольку
Е  наименьший).
наименьший).
В случае б) на катоде: К (-) Cu2+ + 2e ® Cu0 (происходит восстановление меди, поскольку Е  > E
> E  ),
),
а на инертном аноде: : А(+) 2Н2О – 4е ® О2 + 4Н+ (происходит окисление воды, так как E  < E
< E  ).
).
Дата добавления: 2016-02-27; просмотров: 1247;
