Гальванические элементы
Гальванические элементы (ГЭ) - это системы или устройства, в которых энергия гетерогенных окислительно-восстановительных реакций превращается в энергию электрическую. В основе работы всех ГЭ лежит явление возникновения потенциала на границе металл - электролит. Стоит внимательно изучить по учебнику особенности процесса возникновения электродного потенциала, обратив внимание на факторы, влияющие на его величину (температура, концентрация раствора электролита, материал электрода др.). Вполне понятно, что разные по природе металлы имеют различную электролитическую упругость растворения (т.е. способность посылать свои ионы в раствор). Отсюда следует, что при одинаковых условиях величина электродных потенциалов различных металлов будет разная. Впервые зависимость величины электродного потенциала (Е) от различных факторов определена В.Нернстом (1888 гг.):
Е = RT/nF · lnC/C0 ,
где R- универсальная газовая постоянная; Т - абсолютная температура (К); n - число электронов в реакции окисления металла; F - постоянная Фарадея; C и С0 - концентрация иона металла в глубине раствора и на поверхности электрода. Концентрацию С0 невозможно определить точно; отсюда следует, что абсолютное значение электродного потенциала определить невозможно. На практике определяют разность потенциалов, то есть, потенциал данного электрода относительно другого электрода, потенциал которого принят за стандарт. Чаще всего таким стандартным электродом выступает нормальный (стандартный) водородный электрод, потенциал которого принят за 0 В. В этом случае величину электродных потенциалов (Е) можно вычислить по уравнению Нернста:
Е = Е0 + 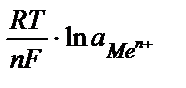 или в упрощенном виде Е = Е0 +
или в упрощенном виде Е = Е0 + 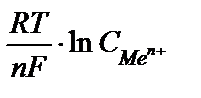 , где Е0 - стандартный электродный потенциал металла - табличные данные, R - универсальная газовая постоянная, Т - абсолютная температура (К), n - число электронов в реакции окисления металла, F - постоянная Фарадея, а
, где Е0 - стандартный электродный потенциал металла - табличные данные, R - универсальная газовая постоянная, Т - абсолютная температура (К), n - число электронов в реакции окисления металла, F - постоянная Фарадея, а 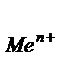 - активность металла а
- активность металла а 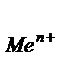 = f× С
= f× С 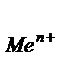 (f - коэффициент активности).
(f - коэффициент активности).
Если принять, что температура, при которой определяется потенциал, равна 250С (298 К), то после небольших преобразований имеем с небольшой погрешностью удобную для большинства расчетов формулу: Е = Е0 + 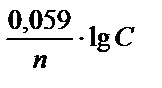 . Здесь Е0 - стандартный электродный потенциал данного электрода относительно нормального водородного электрода при условии, что концентрация (точнее, активность а) ионов металла равна 1 моль / л.
. Здесь Е0 - стандартный электродный потенциал данного электрода относительно нормального водородного электрода при условии, что концентрация (точнее, активность а) ионов металла равна 1 моль / л.
Гальванические элементы принято обозначать в виде формул. Например, формула элемента Даниэля-Якоби:
анод (-) Zn │ Zn2+(С1)││ Cu2+(С2) │ Cu (+) катод
На аноде протекают процессы окисления (отдачи электронов), на катоде - восстановления (принятие электронов). При этом электроны перемещаются по внешней цепи, выполняя полезную работу. Таким образом, при работе ГЭ процессы окисления и восстановления пространственно разобщены. Э.Д.С. гальванического элемента рассчитывается как разница потенциала катода и анода, каждому из которых соответствует конкретная полуреакции:
Э.Д.С. = Ек – Еа.
Теоретически любая окислительно-восстановительная реакция (ОВР) может служить источником тока, поэтому для любой ОВР можно рассчитать Э.Д.С. по формуле:
Э.Д.С. = DЕ = Еок-ля – Ев-ля.
Если, согласно расчетам, Э.Д.С. > 0, то ГЭ будет работать, а окислительно-восстановительная реакция в данных условиях возможна.
Необходимо ознакомиться по учебнику с разновидностями ГЭ (Вольта, Даниэля-Якоби, Гренэ, Лекланше, концентрационными, воздушно-металлическими ГЭ и др.), а также с устройством и принципом действия аккумуляторов.
Ниже (таблица 8) приведены формулы химических источников тока (ХИТ), которые используются чаще всего. На практике реальный электродный потенциал ΔЕ (Э.Д.С.) всегда ниже, чем рассчитанный по теории. Падение потенциала обусловлено побочными процессами, которые происходят при работе химических источников тока: поляризацией, наличием электросопротивления, потери электричества в зоне контактов: ΔЕпракт. = ΔЕтеор. - IR - ΔЕполяр. - ΔЕконт.
Т а б л и ц а 8
Химические источники тока
| № | Гальванический элемент: Элемент Лекланше Элемент Гренэ “Пуговичного типа” Воздушно-металлический Литиевый Марганцево-магниевый Медно-цинковый Свинцово-цинковый Свинцово-кадмиевый Аккумуляторы: Кислотный Щелочной (Cd/Ni) Щелочной (Fe/Ni) | Формула ГЭ: (-) Zn |NH4Cl|| MnO2 |(C) (+) Zn|H2SO4|| K2Cr2O7| (C) Zn|электролит||Ag2O(или AgО)|катод Me(Al,Zn)|электролит||O2| катод Li|электролит, растворитель| катод Mg|MgBr2||MnO2|(C) Zn|NaOH||CuO|Cu Zn|H2SO4||PbO2|Pb Cd|H2SO4|| PbO2| Pb (-) Pb| H2SO4|| PbO2 |(Pb) (+) Cd|KOH||NiO(OH)|Ni Fe| KOH||NiO(OH)|Ni | Э.Д.С., В 1,5 ~2,0 1,35 ~2,6-2,5 ~2,5-3,5 2,0 0,6-1,0 2,5 2,2 1,95-2,15 1,30-1,34 1,37-1,41 |
Задача 1. Предложите два ГЭ, в одном из которых цинк является анодом, а во втором - катодом. Напишите уравнения реакций, происходящих на электродах при работе этих элементов, рассчитайте Э.Д.С. и ΔG при стандартных условиях.
Решение. Первый ГЭ: анод (-) Zn | Zn2+ || Cu2+ | Cu (+) катод.
На аноде (-): Zn0 - 2e → Zn2+; на катоде (+): Cu2+ + 2e → Cu0.
Э.Д.С. (ΔE) = Eк - Еа = 0,34 - (-0,76) = 1,10 B.
ΔG = -nFΔE = -2 · 96500 · 1,10 = 212300 Дж / моль = 212,3 кДж / моль.
Второй ГЭ: анод (-) Mg | Mg2+ || Zn2+ | Zn (+) катод.
На аноде (-): Mg0 - 2e → Mg2+; на катоде (+): Zn2+ + 2e → Zn0.
Э.Д.С. (ΔЕ) = Eк - Еа = -0,76 - (-2,38) = 1,62 В.
ΔG = - nFΔE = -2 · 96500 · 1,62 = 321 660 Дж / моль = 312,66 кДж / моль.
Задача 2. Составьте схему гальванического элемента, в котором электродами является железо и медь, погруженные в растворы с молярной концентрацией ионов соответственно 1 и 0,1 моль / л соответственно; рассчитайте его Э.Д.С.
Решение. Схема гальванического элемента имеет вид:
анод (-)Fe | Fe2+(1 М) || Cu2+(0,1 M)| Cu (+) катод
Железо имеет меньший потенциал (- 0,44 В) (по сравнению с медью) и является анодом, на котором протекает процесс окисления:
Fe0 – 2e ® Fe2+.
Медь, электродный потенциал которой + 0,34 В, является катодом, то есть электродом, на котором протекает восстановительный процесс:
Сu2+ + 2e ® Сu0 .
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, имеет вид:
Fe0 + Сu2+ ® Fe2+ + Сu0.
Э.Д.С. гальванического элемента определяется как разность электродных потенциалов катода и анода:
Э.Д.С. = Ек – Еа ; E 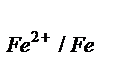 = -0,44 -
= -0,44 - 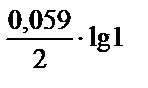 = -0,44 В;
= -0,44 В;
Е 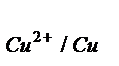 = 0,34 -
= 0,34 -  = 0,31 В. Э.Д.С. = 0,31 – (-0,44) = 0,75 В.
= 0,31 В. Э.Д.С. = 0,31 – (-0,44) = 0,75 В.
Задача 3. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите Э.Д.С. гальванического элемента, состоящий из серебряных электродов, погруженных соответственно в 0,01 М и 0,1 М растворы нитрата серебра.
Решение. Гальванический элемент может быть составлен не только из разных, но и из одинаковых металлических электродов, погруженных в растворы солей этого металла, различающиеся только концентрацией - концентрационные гальванические элементы.
Стандартный электродный потенциал Е0Ag+/Ag = 0,80 В. Обозначим потенциал первого электрода Е1, а второго - Е2, тогда: Е1 = 0,80 + 0,059·lg0,01 = 0,68 В; Е2 = 0,80 + 0,059·lg0,1 = 0,74 В.
Поскольку Е1 <Е2, то первый электрод будет служить отрицательным полюсом элемента (анодом), и электроны будут перемещаться от него к второму электроду (катоду):
(-) Ag │ AgNO3 (0,01 M)││ AgNO3 (0, 1 M) │Ag (+)
Анодный процесс (окисление): Ag0 – e ® Ag+
Катодный процесс (восстановление): Ag+ + е ® Ag0. Суммарно: Ag0+ Ag+= Ag++ Ag0 .
Дата добавления: 2016-02-27; просмотров: 1056;
