Константа хімічної рівноваги
Рівновага при хімічних реакціях
Розглянемо окремий випадок термодинамічної рівноваги – хімічну рівновагу. Як відомо, багато хімічних реакцій є оборотними, тобто можуть одночасно протікати в обох напрямках - прямому й зворотному. Якщо проводити оборотну реакцію в закритій системі, то через якийсь час система прийде в стан хімічної рівноваги. При цьому концентрації всіх реагуючих речовин перестануть змінюватися в часі.
Необхідно відзначити, що досягнення системою стану рівноваги не означає припинення процесу; хімічна рівновага є динамічною, тобто відповідає одночасному протіканню процесу в протилежних напрямках з однаковою швидкістю.
Хімічна рівновага є рухливою – усякий нескінченно малий зовнішній вплив на рівноважну систему викликає нескінченно малу зміну стану системи; по припиненні зовнішнього впливу система вертається у вихідний стан. Ще однією важливою властивістю хімічної рівноваги є те, що система може самовільно прийти в стан рівноваги із двох протилежних боків. Інакше кажучи, будь-який стан, суміжний з рівноважним, є менш стійким, і перехід у нього зі стану рівноваги завжди пов'язаний з необхідністю витрати роботи зовні.
Константа хімічної рівноваги
Кількісною характеристикою хімічної рівноваги є константа рівноваги, що може бути виражена через рівноважні концентрації сi, парціальні тиски рi або мольні частки хi реагуючих речовин. Для довільної реакції
 (3.1)
(3.1)
відповідні константи рівноваги виражають наступним чином:
 (3.2)
(3.2)
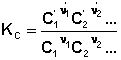 (3.3)
(3.3)
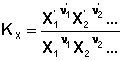 (3.4)
(3.4)
де р1 і р2… - парціальні тиски вихідних речовин, 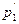 ,
,  ... - парціальні тиски кінцевих речовин; с1, с2 - концентрації вихідних речовин;
... - парціальні тиски кінцевих речовин; с1, с2 - концентрації вихідних речовин;  ,
,  - концентрації кінцевих речовин;
- концентрації кінцевих речовин; 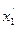 ,
, 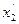 , n1, n2 - стехіометричні коефіцієнти вихідних речовин,
, n1, n2 - стехіометричні коефіцієнти вихідних речовин, 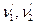 - стехіометричні коефіцієнти кінцевих речовин.
- стехіометричні коефіцієнти кінцевих речовин.
Константа рівноваги Кр відноситься до реакцій, які відбуваються при постійному тиску. Вона залежить тільки від температури і зв’язує парціальні тиски всіх речовин, які беруть участь у реакції. Не можна змінити парціальний тиск жодної з них, щоб це не викликало відповідну зміну парціальних тисків всіх учасників реакції і не призвело би до попереднього чисельного значення константи рівноваги при даних умовах. Такий зміст закону діючих мас.
У тих випадках, коли реакція йде при постійному об’ємі, склад реакційної суміші у стані рівноваги зручно виражати через концентрації або мольні частки. Відповідні константи рівноваги Кс та Кх. Константа рівноваги Кс, так само, як і Кр, залежить тільки від температури. Величина константи Kx, на відміну від Kc і Kp, залежить від загального тиску р.
Знаючи константу рівноваги і склад вихідної системи можна розрахувати склад системи після досягнення рівноваги. Константа рівноваги є характерна величина для кожної оборотної хімічної реакції; величина її залежить тільки від природи реагуючих речовин і температури.
Зв’язок між константами рівноваги Кр, Кс, Кх
На підставі рівняння стану ідеального газу, записаного у вигляді співвідношення рi = сiRT, де сi = ni/υ, і закону Дальтона для ідеальної газової суміші, вираженого рівнянням р = Σрi, можна вивести співвідношення між парціальним тиском рi, молярною концентрацією сi і мольною часткою хi i-го компонента:
 (3.5)
(3.5)
Звідси отримуємо співвідношення між Kc, Kp і Kx:
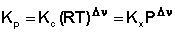 (3.6)
(3.6)
Δν – зміна кількості молей газоподібних речовин при реакції:
Δν = – ν1 – ν2 – ... + ν'1 + ν'2 + ...
Вираз для константи рівноваги зворотної реакції може бути отриманий і з кінетичних уявлень. Ми цього робити не будемо, але знатимемо, що константа рівноваги є відношення констант швидкості прямої і зворотної реакції.
Дата добавления: 2016-02-27; просмотров: 3795;
