Вплив тиску і концентрації
Розглянемо декілька можливих випадків зсуву рівноваги.
1. У систему додано вихідну речовину. У цьому випадку
 ,
, 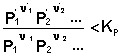
З рівняння ізотерми хімічної реакції отримуємо: ΔF <0; ΔG <0. У системі виникне самочинний хімічний процес, спрямований у бік витрачання вихідних речовин і утворення продуктів реакції (хімічна рівновага зміщується вправо).
2. У систему додано продукт реакції. У цьому випадку
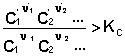 ,
, 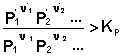
Відповідно до рівняння ізотерми хімічної реакції, ΔF> 0; ΔG> 0. Хімічна рівновага буде зміщено вліво (у бік витрачання продуктів реакції і утворення вихідних речовин).
3. Змінено загальний тиск (для реакцій в газовій фазі).
Збільшення загального тиску система компенсує за рахунок перебігу хімічної реакції, яка характеризується зменшенням загального числа молів газу. Це добре видно з рівняння (3.6): Kc =Kp(RT)-Dn. Kp не залежить від тиску. При Dn<0 (реакція йде зі зменшенням числа молей газоподібних речовин), Kc збільшується із підвищенням тиску, ΔG <0; рівновага зміщується вправо. Навпаки, при Dn > 0 (реакція йде зі збільшенням числа молей газоподібних речовин), то ΔG> 0; рівновага зміщується вліво. Для перебігу прямої реакції в цьому випадку вигідне зменшення тиску.
Інакше кажучи, збільшення загального тиску зміщує рівновагу в бік процесу, що йде зі зменшенням числа молей газоподібних речовин. Зменшення загального тиску газів в суміші буде зміщувати рівновагу в бік реакції, що йде зі збільшенням числа молей газоподібних речовин.
Дата добавления: 2016-02-27; просмотров: 839;
