Вплив температури на положення рівноваги
Підвищення або зниження температури означає придбання або втрату системою енергії і, отже, має змінювати величину константи рівноваги. Константа рівноваги залежить від температури згідно з ізохорою Вант-Гоффа:
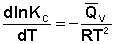 (3.13)
(3.13)
або ізобарою Вант-Гоффа:
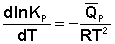 (3.14)
(3.14)
Ізобара і ізохора Вант-Гоффа пов'язують зміну константи хімічної рівноваги з тепловим ефектом реакції в ізобарних і ізохорних умовах, відповідно. Очевидно, що чим більший за абсолютною величиною тепловий ефект хімічної реакції, тим сильніше впливає температура на величину константи рівноваги. Якщо реакція не супроводжується тепловим ефектом, то константа рівноваги не залежить від температури.
Екзотермічні реакції: ΔH <0 ( 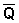 > 0). У цьому випадку, згідно (3.13, 3.14), температурний коефіцієнт логарифма константи рівноваги від'ємний. Підвищення температури зменшує величину константи рівноваги, тобто зміщує рівновагу вліво.
> 0). У цьому випадку, згідно (3.13, 3.14), температурний коефіцієнт логарифма константи рівноваги від'ємний. Підвищення температури зменшує величину константи рівноваги, тобто зміщує рівновагу вліво.
Ендотермічні реакції: ΔH> 0 ( 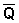 <0). У цьому випадку температурний коефіцієнт логарифма константи рівноваги позитивний; підвищення температури збільшує величину константи рівноваги (зміщує рівновагу вправо).
<0). У цьому випадку температурний коефіцієнт логарифма константи рівноваги позитивний; підвищення температури збільшує величину константи рівноваги (зміщує рівновагу вправо).
Схематичні графіки залежностей константи рівноваги від температури для реакцій з різним тепловим ефектом наведені на рис. 3.1.
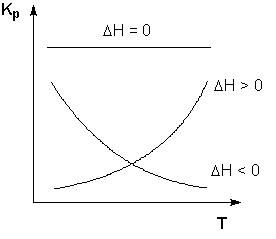
Рис. 3.1. Залежність константи рівноваги від температури
Щоб розрахувати зміну константи рівноваги при зміні температури, рівняння ізобари (ізохори) Вант-Гоффа необхідно проінтегрувати. Якщо прийняти, що тепловий ефект реакції не залежить від температури, що зазвичай справедливо в досить вузькому інтервалі температур, після визначеного інтегрування рівнянь (3.13, 3.14) отримуємо:
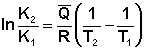 (3.15)
(3.15)
При невизначеному інтегруванні ізобари (ізохори) Вант-Гоффа отримуємо, що константа рівноваги лінійно залежить від оберненої температури:
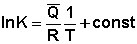 (3.16)
(3.16)
Важливо розуміти, що принцип Лe Шательє діє не тільки для хімічних реакцій, але й для фізичних явищ.
Приклади:
1. При нагріванні замкнутого об’єму, що містить воду і пару, збільшення температури частково стримується тим, що деяка кількість води переходить у пару, поглинаючи при цьому теплоту випаровування.
2. Нехай рідина та тверде тіло знаходяться у рівновазі. Підвищимо зовнішній тиск на цю систему. При цьому частина речовини перейде з одного стану у інший. Куди зміститься рівновага? В напрямку зменшення об’єму. В системі “вода-лід” вода має більшу густину і, відтак, менший об’єм, отже лід буде плавитися. В системі з рідкої та кристалічної сірки, де густина кристалів більша, буде відбуватися додаткова кристалізація. Обидва перетворення частково протидіють підвищенню тиску в системі.
Дата добавления: 2016-02-27; просмотров: 2025;
