Химия элементов IIIA группы
Элементы IIIА группы имеют электронную формулу ns2np1. Они являются значительно менее активными восстановителями, чем щелочноземельные металлы. Для них характерна степень окисления +3, и валентность 3. При образовании ковалентной связи происходит s®p возбуждение электрона и sp2 гибридизация АО. В группе сверху вниз растут металлические свойства элементов, растут восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства:
| Элементы | Оксиды | Гидроксиды | |||
| B | - неметалл | B2O3 | - кислотный | H3BO3 | - кислота |
| Al | - металл | Al2O3 | - амфотерный | Al(OH)3 | - амфотерный |
| Ga | - металл | Ga2O3 | - амфотерный | Ga(OH)3 | - амфотерный |
| In | - металл | In2O3 | - амфотерный | In(OH)3 | - амфотерный |
| Tl | - металл | Tl2O3 | - основной | Tl(OH)3 | - основание |
Соединения Tl3+ являются сильными окислителями и восстанавливаются до соединений Tl+.
Свойства бора и его соединений
Бор находится в природе в виде соединений, например, буры - Na2B4O7´10H2O. Бор является неметаллом. При нагревании взаимодействует с кислородом:
4B + 3O2 ® 2B2O3
Оксид бора является кислотным оксидом и растворяется в воде с образованием слабой ортоборной кислоты:
B2O3 + 3H2O ® 2H3BO3 (К1 = 6×10-10)
Ортоборная кислота H3BO3 при нагревании последовательно разлагается до метаборной кислоты HBO2 , тетраборной кислоты H2B4O7 и борного ангидрида B2O3.
H3BO3 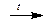 HBO2
HBO2 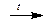 H2B4O7
H2B4O7 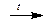 B2O3
B2O3
Ортоборная кислота H3BO3 взаимодействует с щелочами и образует соли тетраборной кислоты:
4H3BO3 + 2NaOH ® Na2B4O7 + 7H2O
Сильные кислоты при взаимодействии с тетраборатом натрия вытесняют слабую ортоборную кислоту:
Na2B4O7 + H2SO4 + 5H2O ® Na2SO4 + 4H3BO3
Ортоборная кислота взаимодействует с этанолом в присутствии концентрированной серной кислоты с образованием борно-этилового эфира, который горит зеленым пламенем.

 O¾H O¾C2H5
O¾H O¾C2H5



 B O¾H + 3HOC2H5 ® B O¾C2H5 + 3H2O
B O¾H + 3HOC2H5 ® B O¾C2H5 + 3H2O
O¾H O¾C2H5
Бор является микроэлементом. Микроэлементы (или микроудобрения) - это соединения B, Cu, Mn, Co, Mo и др. Они повышают активность ферментов, катализируют биохимические процессы, способствуют синтезу белков и нуклеиновых кислот, витаминов, сахаров и крахмала, влияют на фотосинтез, ускоряют рост растений и созревание семян. Соединения бора влияют на углеводный обмен и необходимы для нормального роста и образования семян.
Свойства алюминия и его соединений
В промышленности алюминий получают электролизом расплава боксита Al2O3 в криолите Na3AlF6 при 960оС.
Al2O3  Al3+ + AlO33-
Al3+ + AlO33-
На катоде идет восстановление: Al3+ + 3е ® Al
На аноде идет окисление: 4AlO33- - 12е ® 3О2 + 2Al2O3
Алюминий покрыт инертной защитной пленкой Al2O3. Без оксидной пленки Al очень активен и взаимодействует с кислородом и водой:
4Al + 3O2 ® 2Al2O3
2Al + 6H2O ® 2Al(OH)3 + 3H2
Алюминий взаимодействует с кислотами и щелочами:
2Al + 6HCl ® 2AlCl3 + 3H2
2Al + 6NaOH + 6H2O ® Na3[Al(OH)6] + 3H2
Оксид алюминия имеет амфотерные свойства:
Al2O3 + H2O ¹
Al2O3 + 6HCl ® 2AlCl3 + 3H2O
Al2O3 + 2NaOH 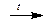 2NaAlO2 + H2O
2NaAlO2 + H2O
Гидроксид алюминия можно получить из солей действием гидроксида аммония или действием недостатка щелочи. Гидроксид алюминия имеет амфотерные свойства.
AlCl3 + 3NH4OH ® Al(OH)3¯ + 3NH4Cl
AlCl3 + 3NaOH ® Al(OH)3¯ + 3NaCl
Al(OH)3¯ + 3NaOH ® Na3[Al(OH)6]
Al(OH)3¯ + 3HCl ® AlCl3 + 3H2O
Соли алюминия гидролизуются. Некоторые из них (Al2S3, Al2(CO3)3) полностью разлагаются водой.
Al2S3 + 6H2O ® 2Al(OH)3 + 3H2S
Алюминий используется для получения металлов - метод алюминотермии. Термитная смесь Al + Fe3O4 при поджигании выделяет большое количество энергии, получаемое железо при этом расплавляется.
8Al + 3Fe3O4 ® 9Fe + 4Al2O3
Алюминий широко применяется как конструкционный материал, а также в электротехнике. Соединения индия и таллия ядовиты. Так сульфат таллия используется как зооцид для борьбы с грызунами.
Дата добавления: 2016-04-11; просмотров: 1220;
