Анализдің электрохимиялық әдістері
Физико- химиялық анализ үш бөлімнен тұрады:
1. Электрохимиялық анализ (ЭХА) – электродтар бетінде немесе электродтар арасында ерітіндіде байқалатын құбылыстар.
2. Спектроскопиялық (оптикалық) анализ – заттың электромагниттік энергиямен әрекеттесуіне негізделген.
3. Хроматографиялық әдістер – сорбент бойымен жылжығанда қоспа компоненттері әр түрлі сорбциялануына негізделген бөлу және анализдеу әдістері.
ЭХА әдістерінде тоқ, потенциал немесе электрөткізгіштің ерітінді концентрациясына тәуелділігін зерттейді немесе ерітіндіні қолайлы титрантпен титрлеп, эквивалентті нүктені анықтау үшін аталған параметрлерді өлшейді. Тоқты және потенциалды өлшеуге де, сырттан беруге де болады. Өлшенетін және берілетін параметрлерді комбинациялауға негізделген бірнеше әдіс бар [47] (кесте 9).
Кесте 9
Электрохимиялық анализдің негізгі әдістері.
| Өлшенетін параметрлер | Берілетін параметрлер. (өлшеу жағдайы) | Әдіс |
| Потенциал, Е,в Тоқ І; мкА, мА Электр мөлшері Q; Кл Меншікті электрөткізгіштік, χ, См/см Масса m; г | І = 0 І = ƒ(Е берілген) І=const, Е= const І = ~ , 1000 Гц І=const, Е= const | Потенциалометрия Вольтамперометрия Кулонометрия Кондуктометрия Электрогравиметрия |
ЭХА анализінде электрохимиялық ұяшық пайдаланады. Ұяшық жеке электролит ерітінділеріне батырылған екі электродтан (көбінесе металдан жасалған) тұрады. Электр энергиясының көзі болатын ұяшық гальвани элементі деп аталады [48].
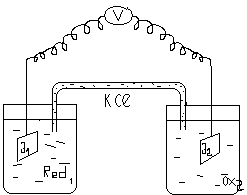
Тізбекті тұйықтағанда тоқ пайда болады.
1. тотықсыздандырғыш Red1 өзінің электрондарын Ох2 тотықтырғышына береді:
-ne
Red1Oх1
2. Э1электроды алған электрондарын сыртқы тізбек арқылы Ох2 –гежібереді.
3. Ох2келген электрондарды қосып алып тотықсызданады.
+ne
Ox2 Red2
Red1+Ox2→ Ox1+Red2
Бұл тотығу- тотықсыздану реакциялары екі жартылай реакциялардан тұрады.
Cонымен бұл ұяшық - гальвани элементі, химиялық реакциялар нәтижесінде электр тоғының көзі болады. Егер электрондар сыртқы тізбекке өтпесе, І = 0, мұнда бұл ұяшық потенциал өлшеу ‰шін пайдаланады. Осы ұяшықты сыртқы электр тоғына қосуға болады. Сонда потенциал жеткілікті болса, тотығу-тотықсыздану реакциясының бағыты өзгереді. Ішінде химиялық реакциялар жүруі үшін сырттан электр энергиясын қажет ететін ұяшықтар электролиттік ұяшықтар деп аталады. Гальвани элементі үшін ЭҚК> 0, ал электрохимиялық ұяшық үшін ЭҚК ≤ 0.
ЭХА- да ұяшықтың екі түрі де пайдаланады. Электродтың біреуі анықталатын зат концентрациясына қайтымды тәуелді болады. Ондай электрод индикаторлы немесе жұмысшы электрод деп аталады. Екінші электрод салыстырмалы электрод болу керек. Ұяшықтар тағы да қайтымды, қайтымсыз болып бөлінеді. Егер тоқ бағыты өзгергенде, ТТР бағыты өзгерсе, онда ол қайтымды ұяшық. Ал егер тоқ бағыты өзгергенде, ұяшықта басқа ТТР жүріп кетсе, қайтымсыз ұяшықтар деп аталады.
Ұяшық арқылы ток көзі өткенде кернеудіњ омдық төмендеуі, поляризация ќұбылыстары байқалады.
1. Кернеудің омдық төмендеуі. Ұяшық арқылы электр тоғы өткенде иондар қозғалысына кедергіні жеңу үшін потенциал қажет. Ол Ом заңына бағынады, ІR тең болады. Осы шаманы кернеудің омдық төмендеуі деп атайды. ІR ұяшық жұмыс істеуіне қажетті потенциалды арттырады, ал өлшенетін потенциалды кемітеді. ІR шамасын ұяшықтың теориялық потенциалы шамасынан алып тастайды:
Еұяшық = Екатод – Еанод – ІR
Мұндағы Екатод – Еанод = Етеориялық
Гальвани элементі 0,1А тоқ тудырса, R=4 Ом болса, онда элемент потенциалы қанша болады. Элемент схемасы: Zn°│Zn2+(1м)║Сu 2+│(1м)│Cu°
Етеор = Е°Cu2+/Cu - E°Zn2+/Zn° = 0.34 – (-0.41) = 0.75B
Еұяшық = Етеор – ІR = 0,75 – 0,1* 4 = 0,35В
Сонымен элемент жұмыс істей бастағанда разрядталады.
2.Поляризация – егер ұяшық арқылы өтетін тоқ шамасы аз болса, онда потенциал мен бір сәттік тоқ арасында сызықтық тәуелділік болады, ал егер тоқ күші артса, сызықтық тәуелділік бұзылыды, яғни элемент поляризацияланады. Сондықтан поляризацияланған ұяшық арасында тоқ өту үшін сыртқы қосымша потенциал қажет. Поляризация электродқа тән, бір электрод немесе екі электрод бірдей поляризацияланады. Поляризацияның екі түрі: а) концентрациялық; б) кинетикалық болады.
а) концентрациялыќ поляризация – электрод маңындағы ион концентрациясы электрод көлеміндегі концентрациядан кем болмауы керек. Электрод бетіндегі реакция тез және қайтымды жүрсе, онда ион концентрациясы электрод потенциалына тәуелді болып, Нернст теңдеуімен анықталады.
Е = E°Cd2+/Cd + 0.058/2 = lg [Cd2+]
Осындай ұяшыққа сырттан потенциал берсе, кадмий иондары тотықсызданады да, бір сәттік тоқ тудырады. Егер әлектродтар маңайына келесі иондар жетіп үлгермесе, тоқ күші түсіп кетеді, концентрация полярлизация пайда болады.
Ал иондардың тасыману жылдамдығы келесі күштерге тәуелді: электростатикалық, механикалық немесе конвекциялық, диффузиялық.
1. Диффузия күштері – ерітіндіде концентрация градиенті болғанда диффузия байқалады. Диффузия жылдамдығы концентрация градиентіне тура пропорционал:
V° =k (C0 – Cх)
C0 – ерітінді көлеміндегі концентрация
Cх – электрод маңайындағы концентрация.
2. Миграциялық немесе электростатикалық .күштер Иондардың өзара тебілу және тартылу күштері тасымалдану жылдамдығын кемітеді.
3. Механикалық араластыру арқылы иондардың тасымалдану жылдамдығын арттыруға, ал концентрациялық поляризацияны кемітуге болады.
Концентрациялық поляризациялану дәрежесі келесі факторларға тәуелді:
а) Анықталатын зат концентрациясына;
б) Электролиттің жалпы концентрациясына;
в) Механикалық араластыруға;
г) Электрод мөлшеріне (бет ауданына);
Электрод мөлшері артқан сайын концентрациялық поляризациялану дәрежесі кемиді. Концентрациялық поляризация кернеудің омдық төмендеуімен қатар элементтің өлшенетін э.ќ.к. шамасын кемітеді.
д) Кинетикалық немесе активациялық поляризация электродта жүретін химиялық реакциялардың жылдамдығы төмен болған кезде байқалады. Жартылай реакциялардың активтену энергиясын жеңу үшін қосымша энергия қажет. Оны аса кернеу деп атайды, ŋ деп белгілейді. Кинетикалық поляризация электрон тасымалдану жылдамдығына тәуелді болады. Аса кернеу мағынасын болжау қиын, себебі ол бірнеше болжанбайтын факторларға тәуелді.
Потенциометрия
Потенциометрия - теңгерілген электродты потенциал мен электрохимиялық реакцияға қатысушы қоспалардың термодинамикалық активтілігі арасындағы тәуелділікті анықтауға негізделген электрохимиялық зерттеудің тәсілі [48].
Потенциометрлік әдіс қайтымды немесе қайтымсыз гальваникалық элеменггердегі электродта пайда болатын электр потенциалдарының айырымын өлшеуге негізделген. Мұны ерітіндідегі заттың мөлшері мен физикалық-химиялық сипаттамасын анықтау үшін қолданады.
Бұл әдісте қолданылатын гальваникалық элемент индикаторлық, салыстырмалық деп аталатын екі электродтан тұрады. Бұларды тасымалсыз элемент болатындай бір ерітіндіге немесе аралары сұйық қосқыш арқылы жалғасқан тасымалды тізбек құратын әр түрлі ерітіндіге енгізуте болады. Индикаторлық электродтың потенциалы ерітіндідегі анықталатын иондардың активтігіне, яғни концентрациясына тәуелді. Ал оның мәнін өзге иондарға тәуелсіз тұрақты потенциалы бар салыстырмалы, яғни қалыпты электрод көмегімен анықтайды. Талдауда қолданатын потенциометрлік әдістің басты артықшылығы - оның аса дәлдігі, сенімділігі, сезімталдығы, оңай қайталампаздығы, сұйытылған, боялған әрі лайлы ерітінділерге қолдану мүмкіндігі. Сондай-ақ, бұл әдіспен алдын ала жеке бөліп алмай-ақ, екі не одан да көп заттан тұратын құрамдас бөліктерді де анықтай береді. Бұл оның талдау мүмкіндігінің шеңберін кеңейте түседі. Мұндағы титрлеуді сулы, сусыз не аралас ортада да жүргізуге болады, яғни суда бөлініп, жеке титрлене бермейтін бірнеше құрамдас бөліктері бар қоспалардың құрамын анықтайды. Мұнымен қатар суда ерімейтін немесе суда ыдырайтын біраз өнімдерді де талдауға болады. Бұл әдістің тағы да бір артықшылығы сигналдарды, сенсорларды пайдаланып, титрлеу ісін автоматты жүргізуге, тіпті едәуір қашықтықтан (не көрші бөлмеден де) басқаруға болады.
Бір бірімен байланысқан тотықтырғыш пен тотықсыздандырғыш тотығу – тотықсыздану жұбын түзеді. Мысалы:
MnOˉ4 +8H+ + 5 e → Mn2+ + 4 H2O
Тотыққан түрі - MnOˉ4
Тотықсызданған түрі – Mn2+
Жеке редокс жұптың потенциалын тікелей өлшеуге болмайды. Оны тек екіншісімен салыстырмалы түрде өлшей аламыз. Жұптардың салыстырмалы сипатамасын электродтар потенциалын – шартты түрде стандарт деп алынған бір элементпен қайта-қайта қиыстырып салыстыру арқылы алады.
Мұндай электродтардың бірі - стандартты сутек электроды. Ол 1,013*10 Па (1 атм) қысымда газ тәрізді сутек үзбей жіберіліп тұратын және сутек ионының активтілігі 1-ге тең қышқыл ерітіндісіне батырылған платиналанған платинадан тұратын жүйе. Платиналанған платина сутекті сіңіріп, редокс жұбы бар электрод ретінде жұмыс істейді.
Н2 (газ) = 2 Н+ + 2е
Мұндай электродтың потенциалы барлық температурада нөлге тең деп қабылданған. Сондықтан өлшенетін электрод потенциалы – бұл элементтің ЭҚК, ол берілген және стандартты сутек электродынан (ССЭ) құралады.
Электродтарды индикаторлы және салыстырмалы деп 2 түрге бөледі. Индикаторлы электрод потенциалы ерітіндідегі ион концентрациясына қайтымды тәуелді болады. Салыстырмалы электрод потенциалы ерітінді концентрациясына тәуелсіз, тұрақты және белгілі болады.
Электрод потенциалы (Е) электрод процесіне қатысатын заттардың активтілігі немесе концентрациямен байланысты. Ол тәуелділік Нернст теңдеуімен көрсетіледі: 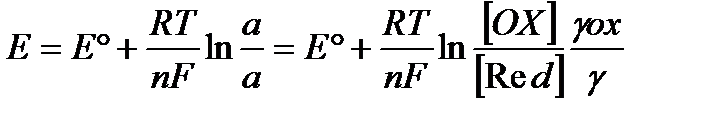
Е˚ - редокс жүйенің стандартты потенциалы;
R – универсал газ тұрақтысы, 8,312 (Дж/моль/К)
Т – абсолютті температура, К.
F – Фарадей тұрақтысы, 96500 (Кл/моль).
n – электродтық реакцияға қатысқан электрон саны.
aох, ared – редокс жүйедегі тотыққан және тотықсызданған формалардың активтілігі.
[Ох], [Rеd] – олардың молярлы концентрациясы.
γох,γred - активтілік коэффиценттері.
Мысалы: Zn2+ + 2e- → Zn
Электрод потенциалы Нернст теңдеуі бойынша табылады:
EZn2+/Zn = E°Zn2+/Zn +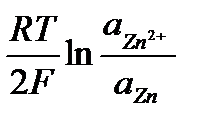
Бос металл активтілігі тұрақты болады, сонда потенциал тек Zn2+ ионының концентрациясына тәуелді болады.
Потенциометриялық әдіс электр қозғаушы күшін өлшеуге негізделген
Е = Е1 – Е2
Е – ЭҚК
Е1 және Е2 – электрод потенциалы.
Потенциометриялық анализ әдісі тура потенциометрия (ионометрия) және потенциометриялыќ титрлеу болып екіге бөлінеді. Тура потенциометрия әдісі зерттелетін ерітіндіге батырылған индикаторлы электрод потенциалын өлшеп, Нернст теңдеуі бойынша ион концентрациясын есептеуге негізделген.
Индикаторлық электродтың тепе-теңдіктік потенциалы ерітінді құрамына тәуелді. Тәуелділік Нернст теңдеуіне бағынады. Индикаторлық электрод потенциалын анализденетін ерітіндіге титранттың әрбір порциясын қосқаннан кейін өлшеп отырады. Эквиваленттік нүкте маңайында потенциал күрт өзгереді (секірме). Потенциометриялық титрлеу нәтижесін есептеу үшін титранттың эквивалентті көлемін табу қажет. Эквиваленттік нүктені көбінесе графиктік әдіспен, яғни титрлеу қисығынан табады.
Титрлеу қисықтарының 4 түрі болады:
1. Интегралдық қисық: Е – V координатасында салынады.
2. Дифференциалдық қисық: ΔE/ΔV - V.
3. ІІ туынды бойынша дифференциалдық қисық: Δ2 E/ΔV2 - V.
4. Гран қисығы: ΔV/ ΔE – V.
Эквиваленттік нүктені дифференциалдық қисықтан тапқан дұрыс.
Қолданылатын реакция түріне байланысты потенциометриялық титрлеудің келесі әдістері болады: қышқылдық-негіздік, тұндыру, тотығу-тотықсыздану, комплекс түзу титрлеу әдістері. Тұндыру әдісінде потенциал секірмесі түзілетін тұнба ерігіштігі кеміген сайын артады. Эквиваленттік нүктедегі потенциал шамасы тұнба үстіндегі қаныққан ерітінді концентрациясына тәуелді. Индикаторлық электрод ретінде металл электроды (катионы ерітіндіде болатын металдан жасалған), ерітіндіде бар ионға сезімтал мембраналық электродтар пайдйланады. Комплексометрия комплекс түзу реакциясына негізделген. Түзілетін комплекстің тұрақсыздық константасы кеміген сайын потенциал секірмесі артады. Индикаторлық электрод ретінді платина, күміс, сынап пайдаланады. Қышқылдық негіздік титрлеуді лайлы және түсті ерітінділерді титрлеуде пайдаланады. Қосылған титрант көлеміне байланысты ерітінді рН-ын өлшейді. Көбінесе шыны электроды пайдаланады. Тотығу-тотықсыздану әдісімен титрлеу кезінде тотыққан және тотықсызданған формалар концентрацияларының қатынасы өзгеру себебінен ред-окс-жүйе потенциалы өзгереді. Титрант тотықтырғыш немесе тотықсыздандырғыш болады. Титрлеу қисықтары билогарифмдік болады, себебі потенциал өзгерісі формалар концентрациясының қатынасына тәуелді. Потенциал секірмесі жүретін ТТР э.қ.к. шамасы артқан сайын және бастапқы концентрациялар артқан сайын артады.
Полярография. Ток пен потенциал арасында вольтамперлік қисықтарды зерттейтін негізгі әдістер вольтамперометрия әдістері деп аталады. Бұл әдістер электролизге негізделеді. Егер электролиз жүретін электрод тамшылы сынап электроды (ТСЭ) болса, онда әдіс полярография деп аталады. Вольтамперометрияда көбінесе айнымалы платина немесе графит электроды, кейде стационарлы сынап электроды немесе қабыршақты сынап электроды пайдаланады [32].
Классикалық полярография әдісін 1922 жылы Гейровский ашты. Катод ретінде ТСЭ пайдаланды, ал анод ретінде поляризацияланбайтын каломельді электрод немесе түптік сынап электроды пайдаланды. Мұндай ұяшықта электр қозғаушы күшінің (ЭҚК) өзгерісі катод потенциалын өзгертуге жұмсалады.
1. Егер анодтың ауданы өте үлкен болса, онда ол поляризацияланбайды, потенциалы өзгермейді Еа тұрақты болады.
2. Егер ерітінді кедергісін азайтса, онда ІR – ді ескермеуге болады.( ІR→0) кедергіні кеміту үшін ерітіндіге фондық электролит қосады. Оның мөлшері 100 есе артық болу керек, ал иондары электролизге ұшырамауы керек, яғни индифферентті болу керек. Фондық электролит ретінде сілтілік, сілтілік жер металдар тұздары, буферлі ерітінділер пайдаланылады. Осы екі жағдай орындалғанда сырттан берілген потенциал катод потенциалын өзгертуге жұмсалады.
Ерітіндідегі еріген оттекті жою керек. Себебі ТСЭ-да еріген оттек те тотыға алады. Ол үшін ұяшық арқылы 15-20 минуттай инертті газ үрлейді (азот, гелий). Егер ерітінді ортасы сілтілік болса, натрий сульфитінің (Na2SO3) 1-2 кристалын салып жіберуге болады.
2 Na2SO3 + О2 → 2 Na2 SO4
Полярограф схемасы.

1. Тұрақты тоқ көзі.
2. Полярографиялық ұяшық
АВ – реохорд
С – жылжымалы контакт
V – вольтметр
Полярографиялық ұяшықтың түрі:
G – гальванометр 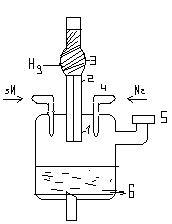
1. шыны капилляр ұзындығы 5-10 см; d – 0,05мл
2. полиэтилен түтігі;
3. сынап резервуары;
4. газ үрлеуге арналған түтік;
5. ерітінді ауыстыруға арналған варонка;
6. түптік сынап, яғни анод
Іd зат концентрациясына тәуелділігі Илькович тендеуі арқылы есептеледі.
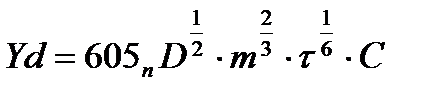

Іd – диффузиялық тоқ; мкА
n- электрон саны
Д – заттың диффузиялық коэффициенті; см2/с. Көбінесе Д =n*10-5-n*10-6
m – 1 секунд ішінде тамған сынап массасы; мг/с
τ – тамшының өмір сүру уақыты немесе тамшылау периоды; с
С – деполяризатор концентрациясы; мммоль/л
Практикада Илькович теңдеуі сирек пайдаланылады. Себебі D бойынша таблицалық мәліметтер аз.
Концентрацияны келесі әдістермен анықтайды:
1. Калибровкалық әдіс;
2. Салыстыру әдісі;
3. Қоспа қосу әдісі;
Полярографияның және тамшылы сынап электродының артықшылықтары:
1. Әдіс металл иондарының, кейбір органикалық қосылыстардың мөлшерін анықтауға, биологиялық материалдар (қан, сары су) анализінде пайдаланады.
2. Өте сезімтал әдіс, 10-5 – 10-6  моль мөлшерді анықтауға болады. Ерітінді көлемі 1-2 мл, кейде 0,01мл болса жеткілікті.
моль мөлшерді анықтауға болады. Ерітінді көлемі 1-2 мл, кейде 0,01мл болса жеткілікті.
3. Тамшылы сынап электродының беті үнемі жаңарып тұрады, сондықтан қайталанғыш нәтижелер алынады.
4. Орташа тоқ бір сәтте түзіледі.
5. Сутек молекуласының сутек иондарынан түзілу аса кернеуі жоғары, сондықтан күшті қышқылдық ортада жұмыс істеуге болады.
Кемшіліктері:
1. Сынап оңай тотығады, сондықтан тамшылы сынап электродын анод ретінде пайдалануға болмайды.
2. Капилляр тез бітеледі.
3. Сынап уытты.
Дата добавления: 2016-03-22; просмотров: 6347;
