Индикаторные электроды.
Для определения концентрации (активности) различных ионов в растворе электрометрическим методом на практике используются гальванические элементы, составленные из двух электродов — электрода сравнения с устойчивым и хорошо известным потенциалом и индикаторного, потенциал которого зависит от концентрации (активности) определяемого иона в растворе. В качестве электродов сравнения наиболее часто применяют каломельный и хлорсеребряный электроды. Водородный электрод для этой цели в силу его громоздкости употребляют значительно реже. Гораздо чаще этот электрод используют в качестве индикаторного электрода при определении активности водородных ионов (рН) в исследуемых растворах.
Остановимся на характеристике индикаторных электродов, получивших за последние годы наиболее широкое распространение в различных областях народного хозяйства.

 Хингидронный электрод. Одним из широко распространенных в практике электродов, потенциал которых зависит от активности водородных ионов в растворе, является так называемый хингидронный электрод (рис. 4.16). Этот электрод весьма выгодно отличается от водородного электрода своей простотой и удобством в работе. Он предоставляет собой платиновую проволоку 1, опущенную в сосуд с исследуемым раствором 2, в котором предварительно растворяют избыточное количество порошка хингидрона 3. Хингидрон представляет собой эквимолекулярное соединение двух органических соединений — хинона С6Н4О2 и гидрохинона СбН4(ОН)2, кристаллизующихся в виде мелких темно-зеленых с металлическим блеском игл. Хинон является дикетоном, а гидрохинон— двухатомным спиртом.
Хингидронный электрод. Одним из широко распространенных в практике электродов, потенциал которых зависит от активности водородных ионов в растворе, является так называемый хингидронный электрод (рис. 4.16). Этот электрод весьма выгодно отличается от водородного электрода своей простотой и удобством в работе. Он предоставляет собой платиновую проволоку 1, опущенную в сосуд с исследуемым раствором 2, в котором предварительно растворяют избыточное количество порошка хингидрона 3. Хингидрон представляет собой эквимолекулярное соединение двух органических соединений — хинона С6Н4О2 и гидрохинона СбН4(ОН)2, кристаллизующихся в виде мелких темно-зеленых с металлическим блеском игл. Хинон является дикетоном, а гидрохинон— двухатомным спиртом.
В состав хингидрона входит одна молекула хинона и одна молекула гидрохинона С6Н4О2·С6Н4(ОН)2. При приготовлении хингидронного электрода хингидрон всегда берут в количестве, гарантирующем насыщенность им раствора, т. е. он должен оставаться частично не растворившимся в осадке. Необходимо отметить, что насыщенный раствор получается при внесении очень маленькой щепотки хингидрона, так как его растворимость в воде составляет всего около 0,005 моль на 1 л воды.
Рассмотрим теорию хингидронного электрода. При растворении в воде происходят следующие процессы: хингидрон распадается на хинон и гидрохинон:

Гидрохинон, являясь слабой кислотой, в незначительной степени диссоциирует на ионы по уравнению
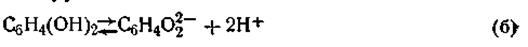
В свою очередь образовавшийся ион хинона может окисляться в хинон при условии отвода электронов:

Суммарная реакция, протекающая на катоде,
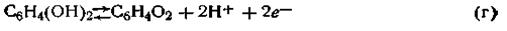
Константа равновесия этой реакции
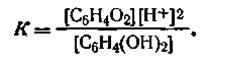
| 4.109 |
Благодаря тому, что в растворе, насыщенном хингидроном, концентрации хинона и гидрохинона равны, концентрация водородного иона постоянна.
Хингидронный электрод можно рассматривать как водородный при очень малом давлении водорода (приблизительно 10-25 МПа). Предполагают, что в этом случае вблизи электрода протекает реакция
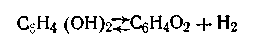
Образующийся газообразный водород насыщает под таким давлением платиновую проволоку или пластинку, опущенную в раствор. Электроны, образующиеся согласно реакции (г), переходят на платину, в силу чего возникает разность потенциалов между платиной и прилегающим раствором. Таким образом, потенциал данной системы зависит от соотношения концентраций окисленной и восстановленной форм и от концентрации ионов водорода в растворе. С учетом этого уравнение электродного потенциала хингидронного электрода имеет вид
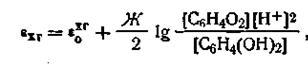
| 4.110 |
где ε0хг — стандартный потенциал хингидронного электрода. Так как в насыщенном растворе хингидрона отношение [С6Н4О2]/ [С6Н4(ОН)2]=1, то уравнение (4.110) примет вид:

| 4.111 |
Из формулы (4.111) видно, что потенциал хингидронного электрода находится в прямой зависимости от концентрации (точнее, от активности) водородных ионов в растворе. В результате практических измерений было установлено, что нормальный потенциал хингидронного электрода (ан+ =1) равен 0,7044 В при 291 К. Поэтому, подставляя в уравнение (4.111) вместо ε0хг и Ж их численные значения, получим окончательное уравнение потенциала хингидронного электрода:
| εХг = 0,7044+0,0577 lg[H+]. | 4.112 |
Таким образом, потенциал хингидронного электрода, так же как и водородного, зависит при данной температуре только от концентрации (активности) водородных ионов в растворе.
|
 Стеклянный электрод. Этот электрод в настоящее время получил самое широкое распространение. Для изготовления стеклянного электрода применяют стекло определенного химического состава. Одной из наиболее часто употребляющихся форм стеклянного электрода является стеклянная трубка, заканчивающаяся тонкостенным шариком. Шарик заполняют раствором НСl с определенной концентрацией ионов Н+, в который погружен вспомогательный электрод (например, хлорсеребряный). Иногда, стеклянные электроды изготовляют в виде тонкостенной мембраны из стекла, обладающего водородной функцией. Мембрана припаивается к концу стеклянной трубки (рис. 4.17). Стеклянный электрод отличается от уже рассмотренных электродов тем, что в соответствующей ему электродной реакции не участвуют электроны. Наружная поверхность стеклянной мембраны служит источником водородных ионов и обменивается ими с раствором подобно водородному электроду. Иными словами, электродная реакция сводится здесь к обмену ионами водорода между двумя фазами — раствором и стеклом: Н+= Н+ст. Поскольку заряд водородного иона соответствует элементарному положительному количеству электричества и переход иона водорода из одной фазы в другую эквивалентен перемещению единичного заряда (n = 1), потенциал стеклянного электрода (εст) может быть выражен следующим уравнением:
Стеклянный электрод. Этот электрод в настоящее время получил самое широкое распространение. Для изготовления стеклянного электрода применяют стекло определенного химического состава. Одной из наиболее часто употребляющихся форм стеклянного электрода является стеклянная трубка, заканчивающаяся тонкостенным шариком. Шарик заполняют раствором НСl с определенной концентрацией ионов Н+, в который погружен вспомогательный электрод (например, хлорсеребряный). Иногда, стеклянные электроды изготовляют в виде тонкостенной мембраны из стекла, обладающего водородной функцией. Мембрана припаивается к концу стеклянной трубки (рис. 4.17). Стеклянный электрод отличается от уже рассмотренных электродов тем, что в соответствующей ему электродной реакции не участвуют электроны. Наружная поверхность стеклянной мембраны служит источником водородных ионов и обменивается ими с раствором подобно водородному электроду. Иными словами, электродная реакция сводится здесь к обмену ионами водорода между двумя фазами — раствором и стеклом: Н+= Н+ст. Поскольку заряд водородного иона соответствует элементарному положительному количеству электричества и переход иона водорода из одной фазы в другую эквивалентен перемещению единичного заряда (n = 1), потенциал стеклянного электрода (εст) может быть выражен следующим уравнением:
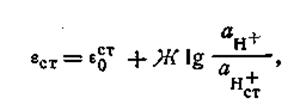
| 4.113 |
где ε0ст — стандартный потенциал стеклянного электрода.
Как показали исследования, в реакцию обмена, помимо ионов водорода, вовлекаются также входящие в состав стекла ионы щелочного металла. При этом они частично заменяются на ионы водорода, а сами переходят в раствор. Между поверхностным слоем стекла и раствором устанавливается равновесие ионообменного процесса:
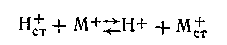
где М+ в зависимости от сорта стекла могут быть ионами лития, натрия или другого щелочного металла.
Условие равновесия этой реакции выражается законом действующих масс:
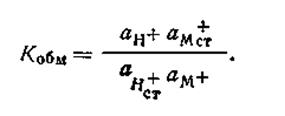
| 4.114 |
Размер этой константы обмена зависит от свойств стекла, из которого изготовлен электрод, а также от температуры. Для исследованных до настоящего времени стекол значение К колеблется от 10 до 10-13.
Исходя из предположения, что в стекле данного сорта сумма активностей ионов водорода и ионов щелочного металла постоянна, т. е.
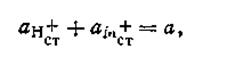
| 4.115 |
уравнение константы обмена можно переписать в следующем виде:
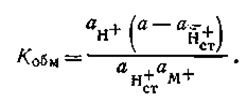
| 4.116 |
Решая это уравнение относительно  , получим
, получим
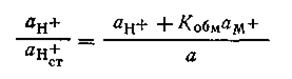
| 4.117 |
Замена ан+ /ан ст+ в уравнении электродного потенциала стекла (4.113) его значением из уравнения (4.117) приводит к следующему выражению:

| 4.118 |
где постоянная Ж 1ga включена в стандартный потенциал стеклянного электрода ε0ст.
Таким образом, в общем случае потенциал любого стеклянного электрода обусловливается двумя величинами: активностью ионов водорода и активностью щелочного металла.
Если в растворе ан+>>Кобмам+, то
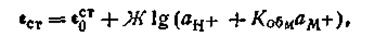
| 4.119 |
т. е. электрод обладает водородной функцией и потому может служить индикаторным электродом при определении рН.
Если в растворе ан+<<Кобмам+, то

| 4.120 |
т.е.электрод обладает металлической функцией. В этом уравнении в величину ε0м входит слагаемое, содержащее константу обмена, т. е.
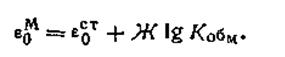
| 4.121 |
Стеклянный электрод с металлической функцией может использоваться в качестве индикаторного электрода для определения активности ионов соответствующего щелочного металла.
Таким образом, в зависимости от сорта стекла (точнее, от размера константы обмена) стеклянный электрод может обладать водородной и металлической функцией.
Изложенные представления о стеклянном электроде лежат в основе термодинамической теории стеклянного электрода, разработанной Б. П. Никольским (1937) и основанной на представлении о существовании обмена ионами между стеклом и раствором.
Схематически стеклянный электрод с водородной функцией можно записать так:

В качестве внутреннего электрода здесь взят хлорсеребряный электрод.
Ввиду того, что в уравнении стеклянного электрода (4.121) величина Ж на практике получается несколько меньше теоретической и ε0ст зависит от сорта стекла и даже от способа приготовления электрода (т. е. является неустойчивой величиной), стеклянный электрод (так же как и сурьмяный) перед определением рН исследуемого раствора предварительно калибруют по стандартным буферным растворам, рН которых точно известен.
Преимущество стеклянного электрода перед водородным и хингидронным электродами заключается в том, что он позволяет определять рН раствора любого химического соединения в достаточно широком диапазоне значений.
Дата добавления: 2016-02-20; просмотров: 4946;
