Электроды сравнения.
Как уже отмечалось, потенциалы различных электродов измеряются по отношению к потенциалу нормального водородного электрода. Наряду с водородным в электрохимии в настоящее время широко применяется другой электрод сравнения — так называемый каломельный электрод, который, как показал опыт, обладает постоянным и хорошо воспроизводимым потенциалом.
| |
Таким образом, платиновая пластинка или проволока, поглотившая молекулярный водород и опущенная в раствор, содержащий ионы водорода, представляет собой водородный электрод. Поскольку сама платина не участвует в электродной реакции (ее роль сводится лишь к тому, что она поглощает водород и, будучи проводником, делает возможным перемещение электронов от одного электрода к другому), химический
символ платины в схеме водородного электрода обычно заключают в скобки: (Pt)H2|2H+.
Существуют различные конструкции сосудов для водородного электрода, две из которых показаны на рис. 4.13.
На поверхности водородного электрода устанавливается равновесие:

В результате этих процессов на границе между платиной и раствором ионов водорода образуется двойной электрический слой, обусловливающий скачок потенциала. Величина этого потенциала при данной температуре зависит от активности водородных ионов в растворе и от количества поглощенного платиной газообразного водорода, которое пропорционально его давлению:
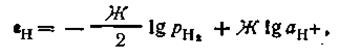
| 4.102 |
где аН+ - активность водородных ионов в растворе; РН2,— давление, под которым поступает для насыщения электрода газообразный водород. Опыт показывает: чем больше давление для насыщения платины водородом, тем более отрицательное значение принимает потенциал водородного электрода.
Электрод, состоящий из платины, насыщенной водородом под давлением в 101,325 кПа и погруженной в водный раствор с активностью ионов водорода, равной единице, называется нормальным водородным электродом.
По международному соглашению потенциал нормального водородного электрода условно принят равным нулю, с этим электродом сопоставляют потенциалы всех других электродов.
В самом деле, при Рн2,— 101.325 кПа выражение для потенциала водородного электрода будет иметь вид
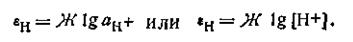
| 4.103 |
Уравнение (4.103) справедливо для разбавленных растворов.
Таким образом, при насыщении водородного электрода водородом под давлением в 101,325 кПа потенциал его зависит только от концентрации (активности) водородных ионов в растворе. В связи с этим водородный электрод может применяться на практике не только как электрод сравнения, но и как индикаторный электрод, потенциал которого находится в прямой зависимости от присутствия Н+-ионов в растворе.
Приготовление водородного электрода представляет значительные трудности. Нелегко добиться, чтобы давление газообразного водорода при насыщении платины равнялось точно 101,325 кПа. Кроме того, газообразный водород должен поступать для насыщения со строго постоянной скоростью, к тому же для насыщения необходимо применять совершенно чистый водород, так как уже весьма малые количества примесей, особенно H2S и H3As, «отравляют» поверхность платины и тем самым препятствуют установлению равновесия Н2↔2Н++2е-. Получение водорода высокой степени чистоты связано со значительным усложнением аппаратуры и самого процесса работы. Поэтому на практике чаще применяется более простой каломельный электрод, обладающий устойчивым и отлично воспроизводимым потенциалом.
Каломельный электрод. Неудобства, связанные с практическим применением водородного электрода сравнения, привели к необходимости создания других, более удобных электродов сравнения, одним из которых является каломельный электрод.
Для приготовления каломельного электрода на дно сосуда наливают тщательно очищенную ртуть. Последнюю сверху покрывают пастой, которая получается растиранием каломели Hg2Cl2 с несколькими каплями чистой ртути в присутствии раствора хлорида калия КСl. Поверх пасты наливают раствор КСl, насыщенный каломелью. Металлическая ртуть, добавляемая в пасту, предохраняет от окисления каломели до HgCl2. В ртуть погружают платиновый контакт, от которого уже идет медная проволока к клемме. Каломельный электрод схематически записывается следующим образом: Hg|Hg2Cl2, KC1. Запятая между Hg2Cl2 и КСl означает, что между этими веществами нет поверхности раздела, так как они находятся в одном растворе.
Рассмотрим, как работает каломельный электрод. Каломель, растворяясь в воде, диссоциирует с образованием ионов Hg+ и Сl-:
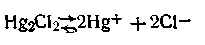
В присутствии хлорида калия, содержащего одноименный с каломелью ион хлора, растворимость каломели снижается. Таким образом, при данной концентрации КСl и данной температуре концентрация ионов Hg+ постоянна, чем, собственно, и обеспечивается необходимая устойчивость потенциала каломельного электрода.
Потенциал (εк) в каломельном электроде возникает на поверхности соприкосновения металлической ртути с раствором ее ионов и может быть выражен следующим уравнением:
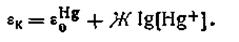
| 4.104 |
Ввиду малой способности ртути переходить в раствор потенциал имеет положительный знак по отношению к потенциалу нормального водородного электрода.
Каломель Hg2Cl2 трудно растворима в воде. При 298 К ее произведение растворимости
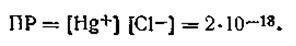
| 4.105 |
Так как ПР при постоянной температуре есть величина постоянная, увеличение концентрации иона хлора может оказать существенное влияние на концентрацию ионов ртути, а следовательно, и на потенциал каломельного электрода.
Из уравнения (4.105)
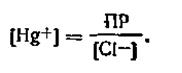
| 4.106 |
Подставляя это выражение в уравнение (4.104), получим

| 4.107 |
Объединяя постоянные при данной температуре величины ε0Нg и Ж lg (ПР) в одну величину и обозначая ее через εок, получим уравнение потенциала каломельного электрода:
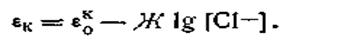
| 4.108 |
Таким образом, потенциал каломельного электрода в конечном итоге зависит от концентрации (активности) ионов хлора в растворе, находящемся над слоем каломели Hg2Cl2, поэтому каломельный электрод может быть отнесен к электродам второго рода.
В насыщенном растворе КСl при 291 К потенциал каломельного электрода εк=0,2503 В; в случае 1 н. раствора КСl εк —0,2864 В, в 0,1 н. КСl εк=0,3380 В. В практике чаще всего применяют каломельные электроды двух типов — с однонормальным раствором КСl и с насыщенным раствором этой соли.

Пользуясь каломельным электродом, можно опытным путем определить потенциал любого электрода. Так, для определения потенциала цинкового электрода составляют гальваническую цепь из цинка, погруженного в раствор ZnSO4, и каломельного электрода

Допустим, что экспериментально определенная э.д.с. этой цепи дает величину E=1,0103 В. Потенциал каломельного электрода εк=0,2503 В. Потенциал цинкового электрода E=εк—εZn, откуда εZn=εK-Е, или eZn = 0,2503—1,0103 = —0,76 В.
Заменяя в данном элементе цинковый электрод медным, можно определить потенциал меди и т. д. Таким образом можно определить потенциалы почти всех электродов.
Хлорсеребряный электрод. Помимо каломельного электрода, в лабораторной практике в качестве электрода сравнения широкое распространение получил также хлорсеребряный электрод. Этот электрод представляет собой серебряную проволоку или пластинку, припаянную к медной проволоке и впаянную в стеклянную трубку. Серебро электролитически покрывают слоем хлорида серебра и помещают в раствор КСl или НС1.
Потенциал хлорсеребряного электрода, так же как и каломельного, зависит от концентрации (активности) ионов хлора в растворе и выражается уравнением
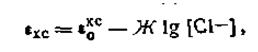
| 4.109 |
где εхс — потенциал хлорсеребряного электрода; еохс — нормальный потенциал хлорсеребряного электрода. Схематически хлорсеребряный электрод записывается следующим образом:

Потенциал этого электрода возникает на границе раздела серебро-раствор хлористого серебра.
При этом имеет место следующая электродная реакция:
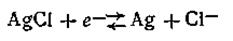
Ввиду чрезвычайно малой растворимости AgCl потенциал хлорсеребряного электрода имеет положительный знак по отношению к нормальному водородному электроду.
В 1 н. растворе КСl потенциал хлорсеребряного электрода по водородной шкале при 298 К равен 0,2381 В, а в 0,1 н. растворе εxc = 0,2900 В и т. д. По сравнению с каломельным электродом хлорсеребряный электрод имеет значительно меньший температурный коэффициент, т. е. его потенциал в меньшей степени изменяется с температурой.
Дата добавления: 2016-02-20; просмотров: 2959;
