Применение закона действующих масс к растворам слабых эектролитов.
К растворам слабых электролитов, как к равновесным гомогенным системам, приложим закон действующих масс. Например, слабая уксусная кислота диссоциирует по уравнению
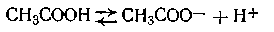
В соответствии с законом действующих масс константа равновесия для этой реакции
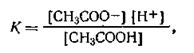
| 4.44 |
где в квадратных скобках указаны равновесные концентрации (в моль/л).
Константа равновесия для случаев диссоциации молекул получила название константы электролитической диссоциации. Эта константа у слабых электролитов не зависит от концентрации раствора (она зависит только от температуры). Так, константа диссоциации уксусной кислоты при 298 К К= 1,85·10-5. Ее малое значение свидетельствует о том, что равновесие в процессе диссоциации уксусной кислоты в растворе устанавливается при большом избытке недиссоциированных молекул. Независимость этой константы от разбавления хорошо подтверждается следующими данными:
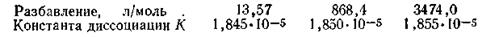
Константа электролитической диссоциации является характеристикой силы электролита. Чем константа диссоциации кислоты
|
или основания больше, тем сильнее данный электролит.
Константа диссоциации имеет постоянное значение (при данной температуре) только для слабых электролитов. Подобного постоянства для сильных электролитов не наблюдается.
Основываясь на законе действующих масс, можно вывести уравнение, которое связывает константу электролитической диссоциации К э
лектролита со степенью его диссоциации и с концентрацией раствора
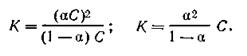
| 4.45 |
Выведенная формула является аналитическим выражением так называемого закона разведения. Этот закон впервые был выведен В. Оствальдом. Он применим только к слабым одновалентным электролитам.
Поскольку концентрация есть величина, обратная разбавлению, т. е. C=1 /V, где V — объем раствора в литрах, содержащий 1 молекулярную массу эквивалента электролита, то с учетом разбавления (разведения) уравнение (4.45) примет следующий вид:
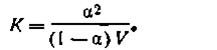
| 4.46 |
Величина а у слабых кислот очень мала, поэтому ею в знаменателе формулы (4.46) можно пренебречь, считая, что 1—a=1. С учетом этого уравнение (4.46) примет более простой вид:
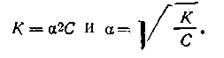
| 4.47 |
Формула (4.47) позволяет вычислить степень электролитической диссоциации слабой кислоты или щелочи, когда константа К известна.
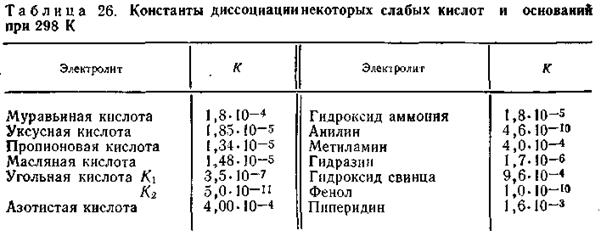
По величине константы диссоциации слабые электролиты делятся на умеренно слабые (К=10-2—10-4), слабые (К=10-5—10-9) и очень слабые (К= 10-10 и меньше).
Опыт показывает, что для растворов сильных электролитов закон разведения Оствальда неприменим, так как для них величина К с увеличением концентрации непрерывно возрастает.
Дата добавления: 2016-02-20; просмотров: 6951;
