Определение степени диссоциации слабых электролитов и коэффициента электрической проводимости сильных электролитов методом электрической проводимости.
Эквивалентная проводимость электролитов находится в прямой зависимости от разбавления раствора. Аррениус объяснил это явление постепенным увеличением числа ионов в растворе: по мере уменьшения концентрации все большее число молекул растворенного вещества диссоциирует на ионы. Он считал также, что эквивалентная проводимость раствора при данном разбавлении λV пропорциональна степени электролитической диссоциации α электролита в этом растворе.
Ранее для эквивалентной электрической проводимости Kv было выведено уравнение Аррениуса, откуда получим
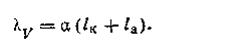
| 4.41 |
Подставляя в уравнение (4.41) значение lк + la из уравнения закона Кольрауша, получим λV= αλ∞, откуда
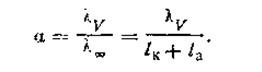
| 4.42 |
Таким образом, степень электролитической диссоциации слабого электролита при данном разбавлении равна отношению эквивалентной электрической проводимости при этом разбавлении к эквивалентной проводимости при бесконечном разбавлении.
Эквивалентная проводимость λV легко может быть определена экспериментальным путем, а λ∞ можно рассчитать по таблицам, пользуясь уравнением (4.41).
Для сильных электролитов отношение эквивалентной электрической проводимости при данном разбавлении к эквивалентной проводимости при бесконечном разбавлении дает уже не α, a fλ,— коэффициент электрической проводимости. Он показывает, во сколько раз действительное значение эквивалентной проводимости λVменьше теоретически соответствующей для данной концентрации электролита, т.е.
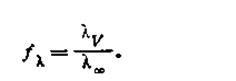
| 4.43 |
Сильные электролиты диссоциированы полностью, и число ионов в растворе постоянно. Поэтому можно было бы ожидать, что для растворов сильных электролитов λV= λ∞. Однако, как показывает опыт, это наблюдается только при бесконечном разбавлении раствора, когда влияние ионной атмосферы на движущийся катион или анион сильно ослаблено. Только при этих условиях эквивалентная электрическая проводимость достигает своего предельного значения и складывается из проводимостей lки lа согласно закону Кольрауша.
Таким образом, коэффициент проводимости сильных электролитов принимает значения меньше единицы не в результате неполной диссоциации, как в случае слабых электролитов, а за счет влияния сил межионного взаимодействия. Иными словами, этот коэффициент обусловливается теми же причинами, что и рассмотренный нами ранее коэффициент активности f.
Величина коэффициента проводимости зависит от концентрации электролита и его валентного типа. Так, в 0,1 н. растворе 1 — 1-валентного электролита fλ = 0,8; для 1—2-валентного электролита fλ=0,75; для 1—3-валентного электролита той же концентрации fλ=0,4 и т. д. По мере же дальнейшего разбавления эти различия постепенно исчезают.
Следовательно, fλ, так же как и a, увеличивается с разбавлением раствора. При достаточном разбавлении fλ и а становятся равными единице.
Дата добавления: 2016-02-20; просмотров: 1779;
