Применение методов измерения электрической проводимости в лабораторной практике и в агрономии.
Измерение электрической проводимости растворов (так называемая кондуктометрия) позволяет решать целый ряд практических задач. По проводимости растворов можно определить растворимость труднорастворимых соединений, влажность различных объектов, содержание солей в воде и в почве и т. п. Кроме того, большое значение имеет определение общей или титруемой кислотности методом кондуктометрического титрования. Рассмотрим вкратце все эти методы, основанные на принципе электрической проводимости.
Определение растворимости малорастворимых соединений. Опыт показывает, что методом электрической проводимости наиболее удобно определять растворимость галидов ртути, серебра и других соединений. Рассмотрим определение растворимости на примере бромида серебра AgBr. Так как AgBr очень мало растворим, его степень диссоциации а в водном растворе должна быть близка к единице, т. е. недиссоциированная часть растворившегося AgBr весьма мала по сравнению с диссоциированной. Поэтому недиссоциированной частью можно пренебречь и считать, что α=1.
Пусть удельная проводимость воды, в которой растворяется бромид серебра, равна χ=1,519·10-4 См·м-1 (при 291 К). Удельная проводимость раствора AgBr в этой воде χ=1,576·10-4 См·м-1. Увеличение электрической проводимости при растворении в воде AgBr обусловлено появлением в растворе (хотя и в малых количествах) ионов Ag+ и Вг-. Таким образом, бромид серебра обеспечивает проводимость, которая равна:
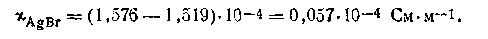
По таблицам подвижностей ионов вычисляем λ∞AgBr=lAg+ +lBr_ =12,71 См·м-l .Поскольку для данного случая α=1, тоисходя из этого, можем записать: λ∞= χ/C, откуда С =χ/λ∞. Подставляя в формулу численные значения отдельных величин, получим
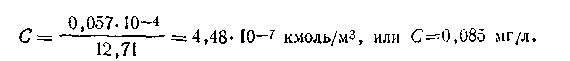
С помощью метода электрической проводимости легко можно вычислять также и произведение растворимости малорастворимых соединений. Так, для бромида серебра можем записать: [Ag+]=[Br-] = 4,48 · 10-7 кмоль/м3. Зная концентрации ионов, нетрудно определить и произведение растворимости (ПР):
[ПР] = [Ag+] [Br-]=4,48·10-7·4,48-10-7 = 2·10-13.
Совершенно аналогичным способом определяют растворимость и произведение растворимости других солей.
Кондуктометрический метод определения влажности.На измерении проводимости растворов основан принцип устройства различных влагомеров. В частности, в практике сельского хозяйства за последние годы получили широкое распространение приборы для определения влажности зерна. Принцип работы этих приборов очень прост. Определенный объем пробы зерна в измельченном виде помещается в специальный сосуд между двумя электродами и с помощью моста Кольрауша измеряется сопротивление этой пробы. Чем больше влаги содержится в зерне, тем меньшим сопротивлением обладает зерно, и наоборот. Шкала прибора градуируется в массовых долях, в процентах для каждого вида зерна. Обычно в целях универсальности прибор снабжается несколькими сменными шкалами для измерения влажности зерна различных сельскохозяйственных культур (например, ржи, пшеницы, ячменя, овса, кукурузы). Указанный метод отличается не только быстротой, но и довольно высокой точностью, и потому все приемные и ссыпные пункты зерна оборудованы такими приборами.
В практике сельского хозяйства наибольшее распространение получил кондуктометрический метод определения влажности почвы. Сущность метода заключается в том, что в почву на заданную глубину погружают специальную штангу, на конце которой имеются электроды, и с помощью портативного моста Кольрауша измеряют сопротивление почвы, находящейся между этими электродами. Чем больше содержится влаги в почве, тем меньшим сопротивлением обладает она, и наоборот. Недостатком этого метода является то, что он неприменим на засоленных почвах, так как растворы солей увеличивают электрическую проводимость почвы.
Определение солесодержания в воде и почвах. Как показывает опыт, степень засоленности почвы часто является решающим фактором при освоении новых земель и выборе наиболее рациональных методов орошения. На орошаемых землях необходим контроль за динамикой солей в почве для проведения мероприятий по предупреждению вторичного засоления.
Классический метод характеристики солесодержания с помощью водной вытяжки имеет два существенных недостатка. Во-первых, при фильтрации водных вытяжек из почвы в фильтраты часто переходят органические и минеральные коллоиды, освободиться от которых бывает очень трудно, и поэтому определение солесодержания по плотному остатку этой вытяжки будет завышенным. Во-вторых, приготовление водной вытяжки, ее фильтрование и выпаривание требуют значительных затрат времени и энергии. Более быстрый и надежный способ определения общего содержания солей в почве основан на измерении проводимости почвенных вытяжек.
 Разработать метод определения солесодержания путем непосредственного измерения проводимости почвы не удалось, поскольку она зависит от многих факторов (в частности, от наличия солей, влажности и других свойств почвы). Поэтому определение солесодержания в почве в настоящее время проводят по величине электрической проводимости почвенной вытяжки. Приборы, с помощью которых производят определение солей в лабораторных и полевых условиях, получили название солемеров. Как известно, кондуктометрическим методом измеряют удельную электрическую проводимость, которая зависит не только от концентрации соли, но и от степени ее диссоциации и скорости движения ионов в электрическом поле, т. е. χ=C αF( Uк + Ua), где С — концентрация соли, а — степень ее диссоциации (кажущаяся); F — число Фарадея; Uк и Ua — скорости движения катионов и анионов при напряжении электрического поля 1 В/м (так называемая абсолютная скорость иона). Это уравнение можно использовать для определения солесодержания, но оно пригодно лишь при известных значениях a, Uки Uа.
Разработать метод определения солесодержания путем непосредственного измерения проводимости почвы не удалось, поскольку она зависит от многих факторов (в частности, от наличия солей, влажности и других свойств почвы). Поэтому определение солесодержания в почве в настоящее время проводят по величине электрической проводимости почвенной вытяжки. Приборы, с помощью которых производят определение солей в лабораторных и полевых условиях, получили название солемеров. Как известно, кондуктометрическим методом измеряют удельную электрическую проводимость, которая зависит не только от концентрации соли, но и от степени ее диссоциации и скорости движения ионов в электрическом поле, т. е. χ=C αF( Uк + Ua), где С — концентрация соли, а — степень ее диссоциации (кажущаяся); F — число Фарадея; Uк и Ua — скорости движения катионов и анионов при напряжении электрического поля 1 В/м (так называемая абсолютная скорость иона). Это уравнение можно использовать для определения солесодержания, но оно пригодно лишь при известных значениях a, Uки Uа.
Водные вытяжки из почв содержат обычно катионы Na+, K+, Са2+, Mg2+ и анионы Сl-, SO42-, HCO3-, СО32-, которые, имеют близкий между собой размеры подвижностей, что обеспечивает методу достаточно высокую точность. Для получения надежных результатов рекомендуется проводить эмпирическую градуировку солемеров в пределах одной почвенной зоны с примерно одинаковым типом засоления.
|
|
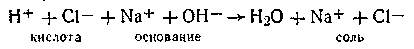
Ион водорода кислоты обладает гораздо большей подвижностью, чем соответствующие катионы соли любого металла. Вполне понятно, что в момент, когда вся кислота (или основание) нейтрализована эквивалентным количеством основания (или кислоты) проводимость раствора минимальна. При добавлении избытка основания (или кислоты) в растворе вновь появятся высокоподвижные ионы ОН- (или Н+), и проводимость раствора начнет быстро возрастать.
Кривая 2 на рис. 4.7 получена в ходе титрования слабой кислоты сильным основанием или слабого основания сильной кислотой. Более крутой подъем после точки эквивалентности обусловлен более высокой диссоциацией образующейся соли по сравнению с диссоциацией титруемой слабой кислоты или слабого основания.
Кривая 3 соответствует титрованию сильным основанием смеси сильной (а) и слабой (b) кислот.
Количество щелочи, которое соответствует наименьшей проводимости, полностью нейтрализует взятую кислоту. Зная объем взятой для титрования кислоты, а также объем и нормальность раствора щелочи, затраченной на нейтрализацию, легко рассчитать нормальность титруемой кислоты по формуле

где V1 — объем раствора кислоты; N1 — нормальность титруемого раствора кислоты; V2 — объем раствора щелочи, пошедшего на титрование кислоты N2 — нормальность щелочи.
Дата добавления: 2016-02-20; просмотров: 3264;
