Типовые задачи и их решение
Задача 1.1. Определите массовую долю раствора (С%), содержащего 60 г NaOH и 140 г воды.
Решение: Массовая доля (С%) выражается формулой (2):
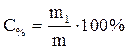 ,
,
где m = m1 + m2 – масса раствора;
m1 = 40 г – масса растворенного NaOH;
m2 = 140 г - масса воды, г .
m = m1 + m2 = 60 + 140 = 200 г.
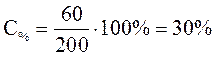 .
.
Ответ: 30 %.
Задача 1.2.Определите массу соли, которая потребуется для приготовления 250 г раствора с массовой долей соли 10%.
Решение: Воспользуемся формулой (2) : 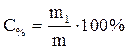 ,
,
где m = 250 г – масса раствора; m1 – масса растворенной соли г.
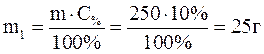 .
.
Ответ: 25 г соли.
Задача 1.3. Определите массу Na2CO3 в г, необходимую для приготовления 2 л 1Н раствора.
Решение: Нормальная концентрация (СН) определяется по формуле (9):
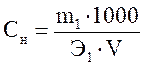 моль-экв/л,
моль-экв/л,
где m1 = масса растворенного Na2CO3, г; Э1 = 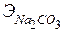 - эквивалентная масса Na2CO3:
- эквивалентная масса Na2CO3:
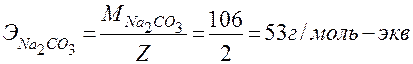 ;
;
V = 2 л = 2000 мл - объем 1 Н раствора.
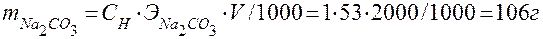
Ответ: масса Na2CO3 - 106 г.
Задача 1.4.Сколько г NaOH надо взять для приготовления 2,5 л 0,1 М раствора ?
Решение: Молярная концентрация определяется по формуле (5): 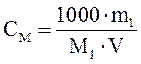 ,
,
где m1 - масса NaOH в приготовленном растворе, г;
М1 = 40 г/моль - мольная масса NaOH;
V = 2500 мл - объем 0,1 М раствора NaOH.
m1 = CM · M1· V / 1000 = 0,1 · 40 · 2500 / 1000 = 10 г.
Ответ : 10 г NaOH.
Часто в лабораторной практике, а также при решении задач необходимо выразить одну концентрацию через другую. В табл. 3 приведены формулы взаимосвязи различных концентраций.
Таблица 3
Взаимосвязь разных способов выражений концентраций
| Концен-трация | С% , % | Сг/л, г/л | См, моль/л | СN, г-экв/л | Т, г/см3 |
| С% | - | 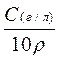 
| 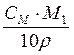
| 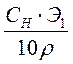
| 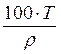
|
| Сг/л | 10·ρ·С% 
| - | СМ · М1 | СН·Э1 | 1000·Т |
| СМ | 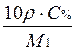
| 
| - | 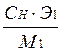
| 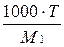
|
| СН | 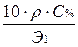
| 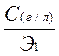 
| 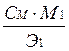
| - | 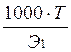
|
| Т | 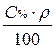
| 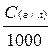 
| 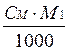
| 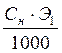
| - |
Задача 1.5.Определите молярную концентрацию (СМ) раствора H2SO4 c массовой долей 30 % и плотностью ρ = 1,22 г/ см3 .
Решение: Воспользуемся формулой (5):
СМ = m1 · 1000 / (M1 · V ),
где m1 - масса растворенной H2SO4 ; М1 = МH2SO4 = 98 г/моль - мольная масса ; V - объем раствора, мл.
Масса 1 л (1000 мл) раствора m1л = ρ · V = 1,22 г/мл · 1000 мл = 1220 г.
В 100 г раствора содержится 30 г H2SO4;
в 1220 г раствора - m1 = 1220 · 30 / 100 = 366 г H2SO4.
CM = 366 · 1000 / 98 · 1000 = 3,73 моль/л (М).
Ответ: СМ = 3,73 М.
Примечание. Эту задачу можно решить также, воспользовавшись формулой взаимосвязи концентраций из табл.3:
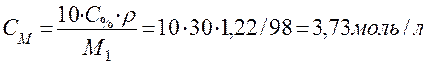 .
. 
Задача 1.6.Определите нормальную концентрацию (СН) в растворе Na2CO3 c плотностью  ρ = 1,105 г/см3 и массовой долей 15%.
ρ = 1,105 г/см3 и массовой долей 15%.
Решение: Воспользуемся формулами (9) и (2).
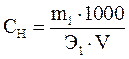 , моль-экв/л, и
, моль-экв/л, и 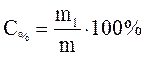 .
.
Выразим массу Na2CO3 (m1) через С%, а массу раствора (m) как произведение плотности на объем m = 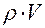 :
:
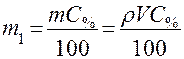
и подставим в формулу для СН:

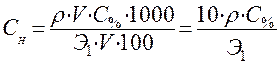 .
.
Примечание. К этой же формуле можно прийти с помощью табл.3. Э1 – эквивалентная масса Na2CO3, которую рассчитаем по формуле:
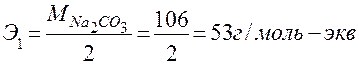 ;
;


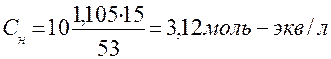 .
.
Ответ: СН = 3,12 моль-экв /л.
Задача 1.7.Определите объем 0,1 Н раствора КОН, необходимый для нейтрализации 200 мл 0,2 Н раствора НСl.
Решение: Согласно закону эквивалентов для реакции, протекающей в растворе:
VKOH · CHCl = VHCl · CH HCl . (10)
Следовательно VKOH = VHCl · C HCl / CKOH = 200 · 0,2 / 0,1 = 400 мл.
Ответ: 400 мл.
Задача 1.8. Определите титр (Т) 0,5 Н раствора H2SO4.
Решение: Титр (Т, г/см2) определяется по формуле (8)
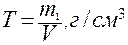 ,
,
а нормальная концентрация СН по формуле (9)

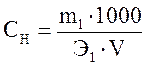 моль-экв/л,
моль-экв/л,
где 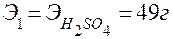 /моль-экв.
/моль-экв.
Выразим массу H2SO4 (m1) через СН: 
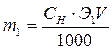
и подставим в формулу (8). Получим выражение:
Т = 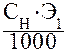 =
= 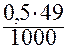 = 0,0245 г/см3.
= 0,0245 г/см3. 
Примечание. Это выражение можно получить, пользуясь табл. 3.
Ответ: Т = 0,0245 г/см3.
Задача 1.9. Определите титр 0,5 М раствора H2SO4 .
Решение: Титр (Т, г/см3) определяется по формуле (8):
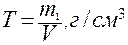 ,
,
а молярная концентрация СМ – по формуле (5):
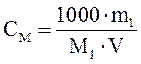 , моль/л, где
, моль/л, где 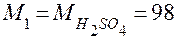 г/моль.
г/моль.
Выразим массу H2SO4 (m1) через СМ:
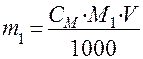 и подставим в формулу (8):
и подставим в формулу (8):
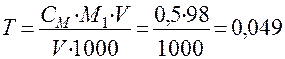 г/см3.
г/см3.

Примечание. К этой формуле можно прийти, воспользовавшись, табл. 3.
Ответ: Т = 0,049 г/см3.
Дата добавления: 2016-02-24; просмотров: 1328;
