Правило фаз Гиббса. Понятие о диаграммах состояния. Типы фазовых диаграмм.
Правило фаз
Металлургические процессы осуществляются в сложных гетерогенных системах, включающих различные фазы. Краткое определение понятия фазы:
ФАЗА - однородная часть неоднородной системы, отделенная от других фаз поверхностью раздела.
Более развернутое определение выглядит следующим образом:
Фазой называют гомогенную часть гетерогенной системы или совокупность нескольких частей, разобщенных поверхностями раздела, одинаковых по химическому составу, строению и свойствам, которые не зависят от массы фазы.
Т.е. наличие поверхности раздела между частями системы не всегда указывает на существование разных фаз. Например, совокупность всех кристаллов определенного состава и одинакового кристаллического строения является одной фазой, несмотря на наличие между кристаллами поверхности раздела. Компонентами называются вещества, образующие сплавы.
Гиббсомбыло сформулировано так называемое правило фаз, позволяющее рассчитать максимальное количество фаз в системе, находящейся в равновесии при заданных внешних условиях (давление и температура):
С = К - Ф + 2
Число степеней свободы (С) в равновесной системе равно разности между числом компонентов (К) и числом фаз +2.
Число компонентов (К) - число индивидуальных веществ за вычетом числа уравнений, связывающих вещества.
В литературе Вы можете встретить другие определения понятия “число компонентов”, которые, по сути, отражают то же самое, что приведенное выше определение. Например:
Компонентами фазы называют индивидуальные вещества, способные существовать в изолированном виде, наименьшее число которых достаточно для образования всех фаз системы". Таким образом, компонентами называют не общее число составляющих систему веществ, а такое их число, которое достаточно для выражения состава любой фазы системы.
Число степеней свободы (С) (или вариантность системы) - число независимых параметров, которые полностью (однозначно) определяют состояние системы. Т.е. такое числе независимых переменных, при изменении которых число фаз, находящихся в равновесии, не изменяется.
Из правила фаз следует, что число фаз в любой гетерогенной системе не может больше, чем К+2, т.к. число степеней свободы не может быть отрицательным. В многокомпонентных системах независимыми параметрами, определяющими состояние системы являются: общее давление, температура и концентрации компонентов (NMe, Nx) или их соотношение.
В 2-х компонентной системе Me-X максимальное число фаз при С=0 равно 4 (газ + 3 конденсированные фазы). В 3-х компонентной системе Фмакс.=5 и т.д.
Правило фаз позволяет определить число независимых параметров, однозначно определяющих состояние системы - число степеней свободы. Так в однофазной двухкомпонентной системе С = 2 - 1 +2 =3. Следовательно, для однозначного определения состояния системы необходимо задать 3 параметра: Р, Т и NMe или Nx. Поскольку в двухкомпонентной системе NMe + Nx = 1 один из концентрационных параметров является зависимым.
Графически фазовые равновесия изображаются с помощью фазовых диаграмм или диаграмм состояния.
На практике нередко встречаются диаграммы, на которых отражаются и неравновесные состояния, например, переохлажденные или перегретые жидкие и твердые фазы. Поэтому, полностью с понятием "диаграмма состояния" не следует отождествлять понятие "диаграмма равновесия фаз", которое отражает равновесное состояние системы, т.е. состояние, когда в системе все превращения полностью завершились. Строго говоря, диаграммами равновесия фаз являются теоретически выведенные диаграммы состояния, т.к. в экспериментальных исследованиях, как правило, не достигается состояния равновесия, и изучаются превращения с различным приближением к этому состоянию. Однако, в большинстве случаев, диаграммы состояния достаточно близко отражают именно равновесное фазовое состояние систем.
Для двухкомпонентной системы в общем случае фазовая диаграмма должна изображаться в координатах Р-Т-Х (P-давление, T - температура, X – состав, выражаемый в концентрации одного из компонентов) т.е. должна быть пространственной. На практике это неудобно и используют плоскостные проекции Р-Т-Х диаграмм: Т-Х, Р-Т или Р-Х диаграммы.
Диаграммы состояния несут в себе много полезной информации металлургам, имеющим дело с высокотемпературными (пиро-) процессами. Во многих случаях не прибегая к сложным термодинамическим расчетам, они позволяют ответить на весьма важные вопросы о возможности осуществления того или иного процесса, составах образующихся фаз, условиях существования жидких фаз и т.д. Поэтому для металлургов фазовые диаграммы весьма важны полезны.
Более всего распространены и хорошо изучены двойные диаграммы основополагающих систем, таких как Fe-C, Fe-O, Fe-S, Cu-S и др. Менее изучены тройные, четверные и т.д. системы как существенно более сложные.
Если для металловедов более интересны двойные диаграммы типа Ме1-Ме2, то для металлургов диаграммы систем, один из компонентов которых металл, а второй - летучий неметалл S, O, Cl и т.д., поскольку наиболее часто пирометаллургические процессы (проводят) протекают в оксидно-сульфидных, оксидно-хлоридных системах.
Прежде чем перейти к рассмотрению типичных проекций диаграмм состояния в координатах Ме-Х,хотелось бы высказать некоторые соображения о строении твердых химических соединений в этой системе. Состав соединений, например оксидов или сульфидов, не отвечает химической формуле, которая ему приписывается, т.е. закон простых кратных отношений не является вполне строгим. Вблизи соединения обязательно существует большая или меньшая область гомогенности. Для доказательства этого положения допустим, что такой области нет и что состав соединения АВфазовой диаграммы, изображенной на рисунке 3.1 точно отвечает стехиометрии. Тогда при температуре t1 в области Iв равновесии находятся жидкость состава а, кристаллы b и газовая фаза. Из правила фаз следует, что для области Iчисло степеней свободы равно 1. Задавая температуру t, мы используем эту единственную степень свободы. Это значит, что для любых сплавов, лежащих на прямой аb состава фаз, химические потенциалы компонентов и равновесные давления кислорода (серы) остаются постоянными и жидкость состава а находится в равновесии с кристаллами b.Аналогично для области II кристаллы состава b должны находиться в равновесии с жидкостью состава c. Таким образом, если допускаем отсутствие области гомогенности вблизи соединения АВ, то приходим к абсурдному выводу о том, что кристаллы состава b одновременно находятся в равновесии с жидкостью состава а и жидкостью состава с. Поскольку газовая фаза в системе общая, это означает, что равновесное давление кислорода (серы) над жидкостями составов а и с равны., чего быть не может, поскольку составы жидкостей и поэтому активности компонентов А и В в них существенно различны. На основании изложенного неизбежно приходим к выводу, что в соответствии с фундаментальными законами физической химии вблизи соединения АВ обязана существовать область гомогенности, внутри которой равновесное давление летучего компонента меняется от значений, отвечающих жидкости состава а, до значений, отвечающих жидкости состава с. То же относится и к другим термодинамическим функциям. Отметим попутно, что в системе А-В не могут существовать также чистые компоненты А и В и что вблизи чистых компонентов также обязательно должна существовать большая иди меньшая область взаимной растворимости компонентов.
Вернемся к области гомогенности вблизи соединения АВ. Если такая область должна существовать неизбежно, то, следовательно, любое соединение типа МеХ должно иметь переменный состав, а термодинамические функции, химические и физические свойства резко меняются в зависимости от состава вещества. Иначе, рассматривая свойства вещества или его термодинамические функции, обязательно следует указывать, к какому точно составу соединения эти свойства или термодинамические функции относятся. Для одного и того же сульфида или оксида, например сульфидов или оксидов меди, железа, цинка, равновесное давление серы (кислорода) отличается на 5-8 порядков. Вместе с этим меняются также физические и химические свойства. Например, электрическое сопротивление СdТе в зависимости от состава изменяется от 10 до 1012 Oм-1.м-1.
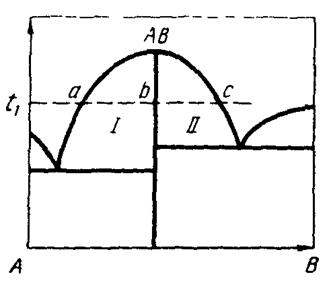
Рисунок 3.1. Гипотетическая диаграмма состояния системы с одним химическим соединением
В соответствии с правилом фаз, каждой точке области гомогенности отвечает строго определенное равновесное давление летучего компонента. Это равновесное давление получило название упругость диссоциации. Если давление летучего компонента над системой не соответствует равновесному давлению, то в системе будут протекать процессы, приводящие к изменению состава фазы. По этой причине исключительно важно знать равновесные давления для всех областей фазовых диаграмм.
Рассмотрим сначала системы, в которых один компонент нелетучий металл, другой летучий элемент или газ (O2,, S2, Р2, Сl2 и т.д.).
Начнем разбирать с системы, в которой образуется одно химическое соединение (рисунок 3.2). В системе А—В имеются пять гомогенных областей (Х, IХ, III, У, УIII), имеющих две степени свободы, ишесть двухфазных областей (1, II, IУ, УI, УII, ХI) с одной степенью. Согласно правилу фаз, в моновариантных областях над всеми сплавами при постоянной температуре (например, на изотерме D-X) создается постоянное давление. Составы фаз также постоянны, поскольку единственная степень свободы была использована была задана температура. Таким образом, изотерма Т-X на Р-Т- проекции проектируется в точку, а вся двухфазная область, или совокупность этих точек, соответствующих изотермам для всего диапазона температур. Далее по диаграммам рассматриваются вопросы:
* области гомогенности, понятие, расположение на диаграмме, число степеней свободы в областях гомогенности двухфазных систем;
* двухфазные (конденсированные) области (моновариантного равновесия), расположение на диаграмме, число степеней свободы в двухфазных (гетерогенных) областях двухфазных систем;
* нонвариантные равновесия
* линии ликвидуса, солидуса;
* твердые химические соединения на диаграммах состояния, области гомогенности хим. соединений
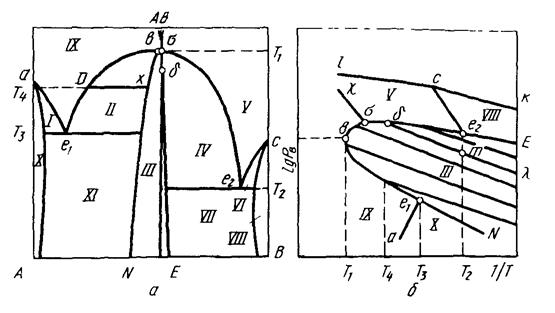
Рисунок 3.2. Диаграмма состояния системы с одним химическим соединением (A и B нелетучий и летучий компоненты соответственно): a - T-X- проекция; б – P-T- проекция.
Аналогично рассматриваются другие типы диаграмм бинарных систем, приведенных на рисунках 3.3-3.5.
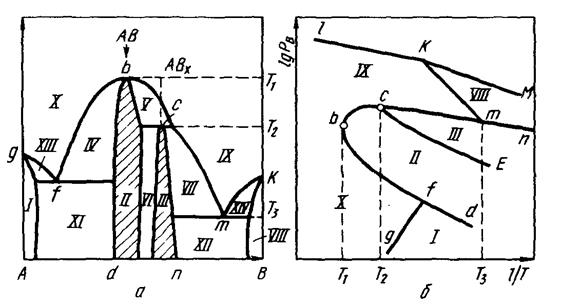
Рисунок 3.3. Диаграмма состояния системы с одним устойчивым и одним неустойчивым химическим соединением: a - T-X- проекция; б – P-T- проекции; LKM – давление пара чистого компонента.
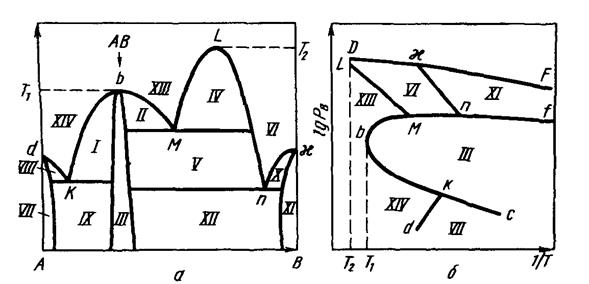
Рисунок 3.4. Диаграмма состояния системы с одним устойчивым химическим соединением и областью расслаивания.

Рисунок 3.5 Диаграмма состояния системы с одним устойчивым химическим соединением и областью расслаивания.
Основные бинарные и тройные диаграммы состояния систем, являющиеся основой расплавов пирометаллургических процессов. Применение диаграмм состояния для анализа пирометаллургических процессов
Рассмотрим вид и основные характеристики важнейших для цветной металлургии реальных систем: Fe-O, Cu-O, Fe-S и др., которые составляют основу многих руд, шлаковых и штейновых расплавов.
Дата добавления: 2016-02-09; просмотров: 3501;
