Фазовые диаграммы Me-O
Система Fe-O
Эта система является важнейшей, как для черной, так и для цветной металлургии. Именно поэтому ей посвящено наибольшее количество исследований, касающихся как фазового состава, так и свойств твердых фаз и расплавов.
T-X диаграмма, построенная по данным Даркена и Гурри, в настоящее время представляется наиболее надежной (рисунок 3.6).
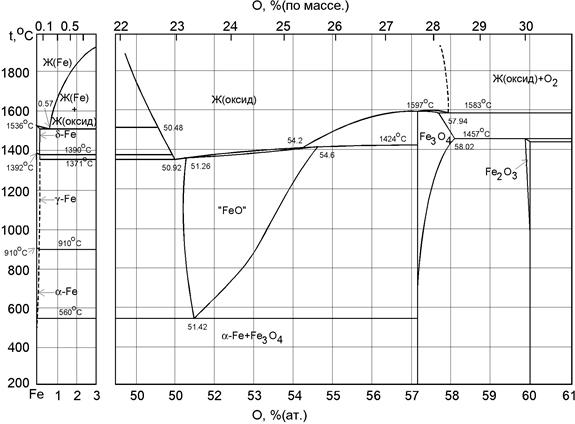
Рисунок 3.6. Диаграмма Fe-O
Известны следующие модификации железа в твердом состоянии: α-Fe (устойчиво до 1041 К), β-Fe (1185-1667 K) и δ-Fe (1667-1811 K). При 1042 К железо претерпевает магнитное превращение (точка Кюри).
Поскольку, как отмечалось выше, абсолютно чистых веществ в системе Me-X не существует, то вблизи оси ординат диаграммы Fe-O существует область твердых растворов, увеличивающаяся с повышением температуры, однако, максимальная предельная растворимость кислорода не превышает сотых долей процента.
В системе железо-кислород известны три оксида: гематит Fe2O3, магнетит Fe3O4 и вюстит Fe1-XO. Все они, а особенно вюстит, обладают значительной областью гомогенности.
Стабильность ограничена пределом температуры в 843 К, ниже которой вюстит разлагается на металлическое железо и магнетит:
4FeO = Fe + Fe3O4
Избыточное содержание кислорода в вюстите по отношению к стехиометрии незначительно изменяется с ростом температуры от 973 до 1673 К на границе Fe- Fe1-XO (1,057 до 1,053) и несколько больше на границе Fe1-XO- Fe3O4 (1,094-1,197).
Содержание кислорода при 16673 К в гомогенном твердом вюстите возрастает от 23,18 до 25,54 % (по массе).
Второе химическое соединение – магнетит, до 1073 К имеет очень узкую область гомогенности. Выше этой температуры область гомогенности расширяется. Причем, левая сторона области гомогенности практически точно совпадает с составом стехиометрического Fe3O4. Справа о этой области состав магнетита выше 1073 К можно представить формулой Fe3-XO4.
Значительно меньше данных о фазовом состоянии гематита, особенно в области высоких температур. Можно с определенной уверенностью говорить о том, что правая сторона области гомогенности гематита вплоть до высоких температур близка по составу к стехиометрии Fe2O3. Левая сторона как будто бы имеет отклонение влево. О причине разупорядоченности в структуре гематита достаточно надежные сведения отсутствуют. При комнатных температурах область гомогенности гематита, по-видимому, невелика и для технологических расчетов металлургических процессов его состав можно принять близким к стехиометрическому - Fe2O3.
На фазовой диаграмме Fe-O имеется ряд одно- и двухфазных областей, где в равновесии находятся конденсированные фазы и газ с определенной концентрацией кислорода. К однофазным системам относятся: Fe-вюстит, вюстит- магнетит, железо-магнетит, расплав-конденсированные фазы, магнетит-гематит.
Система Cu-O
В системе Cu-O образуется два химических соединения Cu2-XO, которому отвечает природный минерал куприт, и оксид меди CuO (природный минерал тенорит) (рисунок 3.7.). Так же как и вюстит Cu2-XO может существовать в определенном температурном интервале (375-1200 °С, При охлаждении ниже температуры 375 °С протекает реакция дисропорционирования:
Cu2O = Cu + CuO
При этом образуется медь, насыщенная кислородом, и оксид меди, отвечающий по составу медному краю области гомогенности. Монооксид меди сравнительно малоустойчивое вещество, хотя и плавится без разложения. Область его существования в жидком виде сравнительно невелика.
Монооксид меди и металлическая медь ограниченно растворимы друг в друге. Область расслаивания занимает значительную часть диаграммы.
Эвтектика медь – монооксид меди содержит 1,85 % O и имеет температуру плавления 1065 °С .
Оксид меди соединение неустойчивое. Оно полностью разлагается на воздухе при 1122 °С, т.е. горизонталь 1120 отвечает нонвариантному равновесию следующих фаз: CuOтв., жидкость, содержащая 14 % O, и газовая фаза. Области устойчивости различных фаз в зависимости от PO2 и T приведены на рисунке 3.7. В связи с малым масштабом области гомогенности показаны одной линией. Однако это не свидетельствует об отсутствии областей переменного состава. В частности, для Cu2-XO так же, как и для Fe1-XO, наиболее характерными дефектами являются вакансии в подрешетке меди, а область гомогенности следует рассматривать как раствор вакансий меди в решетке Cu2-XO.
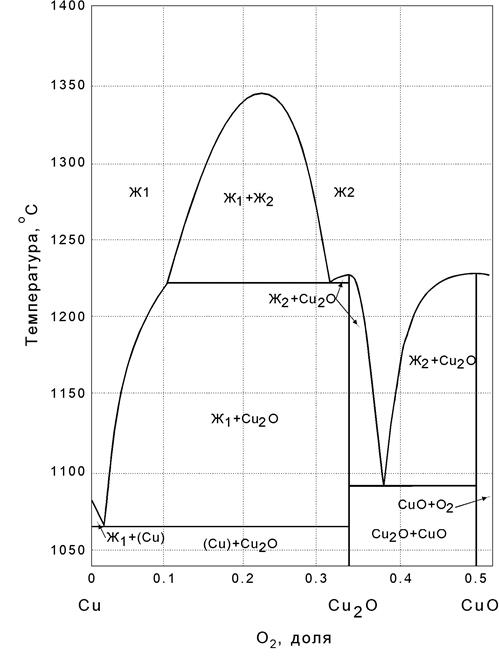
Рисунок 3.7. Диаграмма Cu-O
Дата добавления: 2016-02-09; просмотров: 2649;
