Термодинамика процессов диссоциации
Введение
В практике пирометаллургии цветных металлов исходным сырьем являются: руда, концентраты, промежуточные продукты металлургического производства, в которых ценные компоненты находятся в виде химических соединений: оксидов, сульфидов, галогенидов, карбонатов и др. Металлы могут быть извлечены из этих соединений за счет простейшей химической реакции (термической диссоциации соединений):
МеХ = Ме + Х
где Ме — металл; Х — анион.
Основоположником теории термической диссоциации соединений справедливо считают академика А.А. Байкова, который еще в 20-е годы изложил основные принципы этого процесса. Для анализа процесса А.А. Байков предложил воспользоваться термодинамическим методом. В условиях равновесия в изолированной системе Ме-X при давлении, равном 105 Па (в пирометаллургии вакуумные процессы еще не нашли широкого применения) при любой температуре в газовой фазе должно находиться равновесное количество катионов Ме, анионов Х и паров самого соединения: Кр = РMеРХ/РМеХ
Реакция диссоциации требует затраты тепла и поэтому в соответствии с принципом Ле-Шателье при повышении температуры равновесие реакции должно смещаться в сторону образования продуктов реакции.
Многие металлы имеют несколько форм валентности. При диссоциации их соединений могут образовываться промежуточные соединения низшей валентности. А.А. Байковым в свое время был сформулирован так называемый принцип последовательности превращения. Рассмотрим эту схему на примере диссоциации какого-либо оксида металла:
b1МепОт = b2МеqОp + O2
Здесь b1, b2, n, m, q, р — стехиометрические коэффициенты реакции.
Согласно принципу А.А. Байкова, при равновесном разложении оксида отрыв кислорода от соединения происходит последовательно, скачками, проходя через все те химические соединения, которые могут существовать в системе. Например, диссоциация гематита до железа в равновесных условиях при температуре >570 °С (см. диаграмму) должна проходить по схеме Fе2O3-Fе3O4-Fе1-xO-Fе.
На основании предыдущего изложения мы уже убедились в том, что любое соединение имеет большую или меньшую область гомогенности. Это вносит свои особенности в теорию диссоциации соединений, что и было в свое время отражено в классических трудах А.А. Байкова.
В настоящей лекции рассмотрим термодинамику диссоциации соединений для условий, когда внешнее давление принято равным 105 Па. Это - реальное состояние большинства пирометаллургических агрегатов в настоящее время.
Диссоциация соединений переменного состава при постоянной температуре
Диссоциация соединения связана с переходом летучего компонента в газовую фазу. Прежде всего, необходимо выяснить, какая же реакция при этом протекает? Вопрос этот не является таким простым, как это может показаться с первого взгляда. Возьмем сначала группу соединений с одним летучим компонентом (оксиды, сульфиды, хлориды нелетучих металлов). Для этой группы веществ нужно раздельно рассматривать диссоциацию соединения, лежащего на металлическом крае области гомогенности и внутри области гомогенности. допустим, что был взят вюстит, лежащий на железном крае области гомогенности (см. диаграмму Fe-O). Диссоциация этого соединения, т.е. переход кислорода в газовую фазу при постоянной температуре (1200 °С) приведет к тому, что фигуративная точка, определяющая состояние системы, будет перемещаться в зону устойчивости твердого раствора кислорода в γ-Fe по изотерме t.
Равновесное давление кислорода над системой остается постоянным до тех пор, пока полностью не исчезнет одна из конденсированных фаз. Если давление кислорода в реакционном сосуде будет меньше, чем равновесное давление над вюститом этого состава, то исчезнет фаза вюстита, произойдет его диссоциация. Процесс этот может быть выражен реакцией:
Fe1-xO ↔ (1-x)Fe +1/2O2
Если давление кислорода в реакционном сосуде будет больше равновесного, то реакция пройдет в правую сторону до исчезновения металлической фазы. Важно еще раз подчеркнуть, что при диссоциации вюстита образуется не чистое железо, а железо, насыщенное кислородом. Константа равновесия реакции равна: Кр, = рO21/2рMe /рFe1-xО;
Кp’ ≈ рO21/2
Допустим, что имеется вюстит, состав которого отвечал кислородному краю области гомогенности (диаграмма, точка b), При этом диссоциация соединения, отвечающего точке b, т.е. переход кислорода в газовую фазу и уменьшение его содержания в вюстите вовсе не сопровождается появлением металлической фазы. Фигуративная точка, определяющая состав системы, лишь перемещается внутрь области гомогенности (точка d). При этом уменьшение содержания кислорода приводит к тому, что возрастает отношение железа к кислороду, т.е. уменьшается количество вакансий железа. Величина x в формуле Fe1-xO уменьшается, но вакансии железа двузарядны и исчезновение каждой вакансии сопровождается исчезновением двух дырок.
Увеличение (снижение) концентрации точечных дефектов обуславливает резкое возрастание (уменьшение) равновесного давления летучего компонента. Даже для соединений с узкой областью гомогенности равновесное давление аниона веществ, расположенных на ее краях, отличается на несколько порядков.
Диссоциация соединений с образованием конденсированных фаз постоянного состава
Остановимся более подробно на том случае, когда оксид и металл образуют две фазы постоянного состава, находящиеся в твердом состоянии. В рассматриваемой системе число компонентов равно двум, число фаз - трем. Тогда число степеней свободы системы равно единице (в соответствии с правилом фаз): С = К – Ф +2 = 2 - З +2 = 1. Это значит, что для полного описания состояния такой равновесной системы достаточно одного параметра. В термодинамике состояние системы, как правило, описывается параметрами Р и Т, но один из них является зависимым. За независимый параметр, как правило, принимают температуру. Тогда общее давление в рассматриваемой системе при заданных температуре и составе фаз будет равным:
pобщ. = pO2 = f(T)
Качественно зависимость равновесного давления от температуры можно охарактеризовать с помощью правила Ле-Шателье. Реакция диссоциации соединений является эндотермической. Подвод тепла извне приводит к разложению дополнительного количества вещества до тех пор, пока нарастающее в системе противодействие, выражающееся в конкретном случае в повышении рO2, не приведет к установлению нового равновесного состояния. Напротив, если в системе повышать давление, равновесие реакции диссоциации сдвинется в левую сторону.
Проанализируем вид функции, исходя из следующих соображений. В общем виде константа равновесия реакции диссоциации может быть записана в виде:
К=pO2aMe2/aMeO2
Допустим, что при условиях протекания процесса aMe и aMeO - величины постоянные. Тогда К = PO2.
Для определения зависимости константы равновесия реакции диссоциации (а значит и упругости диссоциации) от температуры можно воспользоваться уравнением изобары:
dlnK/dT = ΔH/RT2
 |
где:
Для практических нужд нередко можно воспользоваться упрощенным уравнением, считая, что ΔH и Ср в исследуемом относительно узком интервале температур мало зависят от температуры. Тогда lnKp = − ΔH/RT + const.
Графически уравнение состояния рассматриваемой системы будет изображаться логарифмической кривой (рисунок 4.1). Поле диаграммы pO2 – T разделено на две области. Кривая на рисунке представляет собой геометрическое место точек, характеризующих равновесное давление в системе с чистыми металлом и оксидом.
Если в исходном состоянии в рассматриваемой изолированной системе давление кислорода было больше равновесного давления рO2‘ >pО2 при температуре Т, то система находилась в неравновесном состоянии (рO2’ - исходное давление кислорода в системе; рO2 - равновесное давление). Стремление системы к снижению свободной энергии и к переходу в равновесное состояние пойдет за счет взаимодействия кислорода с металлом. Изменение изобарного потенциала реакции диссоциации в случае, если внешнее давление не равнялось единице, описывается уравнением:
ΔG = RT (ln(pO2’)-ln(pO2))
 Так как рO2‘> рO2, а RТ> 0, то ΔG > 0. Согласно термодинамике, реакция диссоциации в данном случае не будет иметь места. Наоборот, произойдет обратная реакция - окисление металла кислородом. Переход системы в равновесное состояние в изотермических условиях при отводе выделяющегося вследствие окисления металла тепла можно описать на графике прямой аа’ (изотермические условия). Если процесс осуществляется при сохранении постоянного давления (изобарические условия), то переход системы в равновесное состояние пройдет по линии аa”. Если же ни одно из этих условий не будет соблюдаться достаточно строго, то переход системы в равновесное состояние определяется какой-то траекторией аa’”.
Так как рO2‘> рO2, а RТ> 0, то ΔG > 0. Согласно термодинамике, реакция диссоциации в данном случае не будет иметь места. Наоборот, произойдет обратная реакция - окисление металла кислородом. Переход системы в равновесное состояние в изотермических условиях при отводе выделяющегося вследствие окисления металла тепла можно описать на графике прямой аа’ (изотермические условия). Если процесс осуществляется при сохранении постоянного давления (изобарические условия), то переход системы в равновесное состояние пройдет по линии аa”. Если же ни одно из этих условий не будет соблюдаться достаточно строго, то переход системы в равновесное состояние определяется какой-то траекторией аa’”.
Если парциальное давление кислорода в изолированной системе при температуре Т2 ниже равновесного (рO2’’<рO2), то ΔG реакции будет отрицательна. Это свидетельствует о том, что в системе протекает процесс диссоциации оксида. При этом в зависимости от условий процесс перехода системы в равновесное состояние будет изображаться на графике (рисунок 4.1) отрезками bb’, bb” или b’’’.
Равновесные значения рO2 при заданной температуре принято называть упругостью диссоциации оксидов. Для сульфидов и хлоридов также характерна определенная величина равновесной упругости диссоциации рS2, рCl2 для каждой температуры.
В рассматриваемом случае металл и соединение металла с кислородом, хлором или серой представляют конденсированные фазы постоянного состава Упругость диссоциации, или равновесное давление летучего компонента, служит важной характеристикой данного вещества. Она является мерой прочности вещества и определяет области его устойчивости.
Учитывая эти замечания, можно использовать понятие об упругости диссоциации для оценки прочности соединений. Например, из температурной зависимости упругости диссоциации оксидов (рисунок _), следует, что в атмосфере воздуха (рO2’ = 0,21. 105 Па) наименее устойчивым оксидом будет Аg2О. Действительно, процесс диссоциации оксида, будет иметь место в том случае, когда в системе будет меньше равновесного значения упругости диссоциации. Этот момент наступает для Аg2О при температуре 450 °С, для СuО при 1300 °С. На рисунке 4.2 представлены температурные зависимости упругости диссоциации ряда оксидов и сульфидов, позволяющие оценить вероятность нахождения металлов при определенной температуре и парциальном давлении кислорода, серы в свободном состоянии или в виде соединения. У благородных металлов упругость диссоциации их соединений уже при низких температурах составляет значительную величину. Поэтому такие металлы встречаются в земной коре в свободном состоянии в виде самородных, что нельзя сказать, например, о самородном железе. Зависимость упругости диссоциации FeО от температуры выражается уравнением:
lgРO2 = —26730/Т + 6,43
Диссоциация монооксида железа начнется, когда рO2’≤ рO2. В воздушной атмосфере рO2 = 0,21.105 Па. Для равновесных условий протекание реакции диссоциации 2ЕеО↔ 2Fe + O2 монооксида железа на металл и кислород начнется при температуре 3760 К. При более низких температурах идет обратный процесс, результатом которого будет образование прочных оксидов железа.
 |
Несомненно, более объективной характеристикой сродства металлов к сере, кислороду или хлору служит убыль изобарного потенциала реакции образования соединения из элементов, отнесенная к стандартным условиям. Изменение изобарного потенциала реакнии окисления может быть описано следующим уравнением: ΔG = RT (lnKp’-lnKp) [Kp’ — величина, характеризующая исходное состояние системы (формально записывается так же, как константа равновесия реакции, однако величины, составляющие ее, относятся к неравновесному исходному состоянию)].
Чтобы было удобно сравнивать между собой величины убыли изобарного потенциала образования различных соединений из элементов, за стандартное исходное состояние системы принимают давление 105 Па паров серы или кислорода (анионов) в системе. Константа равновесия реакции окисления (величина обратная диссоциации) металлов для случая нахождения металла и оксида в конденсированных фазах при постоянстве их состава запишется как К=1/PO2. Тогда, нормальное сродство металла к кислороду определяется из выражения: ΔG = RT (ln1 - ln(pO2-1)) = - RT ln(pO2-1) (рO2 - упругость диссоциации оксида).
Величину изменения термодинамического потенциала реакции можно отнести к различному количеству реагирующих веществ. При выражении значения ΔGобразования оксидов и сульфидов из элементов как меры химического средства численное значение убыли термодинамического потенциала всегда относят на 1 молы кислорода или серы.
На рисунке 4.3 приведены температурные зависимости убыли стандартного термодинамического потенциала образования соединений, отвечающих по составу краю области гомогенности. Чем более отрицательные значения имеют величины тем больше сродства у этих металлов к кислороду и к сере, меньше упругость диссоциации соединений, более прочным будет оксид или сульфид. Наоборот, чем положительнее значения убыли термодинамического потенциала образования соединения для какого-либо металла, тем меньше его химическое сродство к кислороду и сере, тем менее прочны оксиды и сульфиды этого металла. Наибольшее сродство к кислороду имеют такие элементы, как кремний, ванадий, алюминий, цирконий, барий, кальций. Наименьшее - серебро, ртуть, медь, свинец.
Наибольшим сродством к сере при высоких температурах отличаются медь, цинк и кальций
 |
Сродство к кислороду у металлов существенно выше, чем к сере. По этой причине при протекании обменной реакции типа Ме’О + Ме”S = Ме’S + Ме”О решающее значение оказывает разность в величинах сродства металлов к кислороду. Например, кальций концентрируется в окисленной фазе, несмотря на его высокое сродство к сере.
При диссоциации высоких оксидов, сульфидов или хлоридов происходит первоначально их разложение на соединения более низкой валентности.
Диссоциация оксидов и сульфидов, образующие растворы
Если соединение и металл образуют друг с другом или с посторонним инертным веществом растворы, то вместо двух конденсированных фаз образуется одна. Число степеней свободы у такой системы равно двум.
Упругость диссоциации соединений будет функцией уже не только температуры, но и состава
рO2 = f(Т, N)
где: NMe+NMeO = 1.
Геометрическое выражение этой зависимости - поверхность. Рассмотрим на примере оксида двухвалентного металла функциональную зависимость упругости диссоциации. В системе из двух несмешивающихся фаз: металлического раствора и раствора диссоциирующего соединения. Уравнение реакции в этом случае имеет следующий вид:
2(МеО) = [Me] + O2
где [Ме] и (МеО) - концентрации соответственно металла и оксида в растворе.
В качестве исходных предпосылок примем, что растворители для металла и оксида инертны по отношению к кислороду. Пусть растворимость металла и оксида будет ограниченной. Предельные концентрации в насыщенных растворах обозначим как [Ме]н.р. и (МеО)н.р.. Константу равновесия реакции можно записать следующим образом:
К = [РМе]2РO2/(РМеО)2
где: РМе и РМеО - равновесные парциальные давления соответственно пара металла и оксида в системе при температуре Т.
Для рассматриваемого случая упругость диссоциации равна:
РO2= К(РMeO)2/(РMе)2
Согласно закону Геири равновесное давление пара вещества над раствором пропорционально молярной доле его в растворе.
Давление пара вещества над насыщенным раствором равно давлению пара чистого вещества (РMe0, рMeO0). Тогда можно записать:
РМе/РMe0 = [Ме]/[Ме]н.р.и РМеO/РMeO0 = (МеО)/(МеО)н.р.
РМе =РMe0 [Ме]/[Ме]н.р. и РМеO = РMeO0 (МеО)/(МеО)н.р.
Подставляя значения упругости диссоциации оксида для системы с раствором, получим:
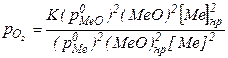
Выражение определяет упругость диссоциции оксидов в том случае, когда металл и оксид растворяются в каких-то растворителях.
Так как 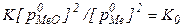 , т.е. константа диссоциации веществ K0, не образующих растворы, то:
, т.е. константа диссоциации веществ K0, не образующих растворы, то:
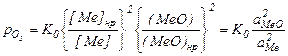
Где: аMеO и аMe активности оксида и металла в растворах Если металл остается в конденсированной фазе, а в раcтворе находится только оксид, выражение упрощается. Так как [Ме]н.р. /[Ме] = 1, то:
PO2=K0[(MeO)/(MeO)н.р.]2
Из выражения следует, чторавновесная упругость диссоциации оксида находится в зависимости от его концентрации (активности) в растворе. Чем меньше концентрация оксида в растворе, тем меньше упругость его диссоциации, тем прочнее оксид и тем труднее его восстановить до металла. При повышении концентрации равновесное давление возрастает лишь до величины, соответствующей рO2 для конденсированного нерастворенного оксида.
Рассмотренная зависимость имеет большое значение в практике пирометаллургии. Например, при высокотемпературном восстановлении оксидов цветных металлов процесс восстановления будет протекать тем легче, чем выше концентрация оксида в расплаве. По этой причине при восстановлении трудно восстановимых оксидов, т.е. имеющих большое сродство к кислороду, стремятся иметь высокую концентрацию их в расплаве Не менее часто встречается задача выделения небольших количеств ценных компонентов из оксидного и силикатного расплавов. Очевидно, при снижении концентрации оксидов в расплаве упругость их диссоциации тоже будет снижаться, что потребует и более жестких условий восстановления. Если в растворе находится образующийся при диссоциации металл, а оксид представлен индивидуальным веществом, то уравнение преобразуется следующим образом: рO2 = К0 ([Ме]н.р. / [Ме])2.
Из этого выражения следует, что упругость диссоциации оксида, когда образующийся металл растворяется в инертном растворителе, всегда больше или равна упругости диссоциации оксида, когда металл находится в элементарной форме.
Выведение образующегося металла в раствор обеспечивает более полное восстановление оксидов, протекающее с меньшими затруднениями. В практике пирометаллургии с образованием металлических растворов приходится встречаться при термическом получении силумина, оловянной электроплавке и т.п.
Дата добавления: 2016-02-09; просмотров: 5010;
