ДОПОЛНЕНИЕ. Серебряная фотография.
Для изготовления светочувствительных пленок стабилизированная желатином эмульсия из мелкозернистых галогенидов серебра с размером частиц до одного микрометра, то есть содержащих примерно по 1012 атомов металла, наносится на прозрачную пленку. Чаще всего используется бромид AgBr, поскольку иодид обладает слишком высокой, а хлорид – слабой чувствительностью к свету.
Фотографический процесс состоит из следующих стадий: (1) получение «скрытого» изображения, который происходит при фотографировании; (2) проявление, или получение негатива; (3) закрепление, или фиксирование изображения; (4) изготовление отпечатков.
При фотографировании под действием света ион Br- теряет электрон
Br- + hn ® Br + 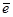
и на поверхности светочувствительного зерна восстанавливает серебро
Ag+ + 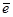 = Ag,
= Ag,
которое выделяется на дефектах кристаллической решетки зерна – дислокациях, вакансиях и т.д. Желатиновый сенсибилизатор связывает выделяющийся галоген, а также увеличивает чувствительность слоя. В местах попадания световых лучей образуются кластеры металлического серебра, но число их столь мало, что они оказываются невидимыми – они формируют «скрытое» изображение.
Этот процесс проявления заключается в усилении «скрытого» изображения. С этой целью увеличивают количество металлического серебра, обрабатывая экспонированную фотопленку мягким восстановителем, чаще всего 1,4-гидрохиноном С6Н4(ОН)2, чтобы. Этот процесс катализируют кластеры серебра, которые уже образовались при фотографировании. Восстановление на них протекает в 1010 раз быстрее, чем в тех местах, где фоточувствительный слой не освещался. В результате этого практически все серебро в экспонированных участках слоя оказывается восстановленным. Неравномерность почернения при проявлении приводит к образованию рисунка фотографируемого объекта, но его наиболее освещенным участкам отвечают темные места и наоборот. Светопередача на пленке оказывается обратной по отношению к оригиналу, поэтому такой снимок называют негативом.
Для предохранения от восстановления, почернения и потери исходного рисунка неразложившийся бромид серебра, оставшийся на пленке, удаляют с помощью фиксажа Na2S2O3 в виде тиосульфатного комплекса
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr.
После такой обработки и промывки водой все серебро находится в виде метлла, и пленка «не боится» света.
При изготовлении отпечатков через негатив пропускают свет, который попадает на фотобумагу с нанесенным на нее фоточувствительным слоем. Благодаря этому светопередача обращается – темным местам негатива на фотобумаге соответствуют светлые и наоборот. Далее повторяются операции проявления и закрепления. Таким образом, получают черно-белые снимки.
Для изготовления цветных фотографий светочувствительная пленка формируется из трех слоев, каждый из которых состоит из галогенидов серебра и сенсибилизаторов, обеспечивающих чувствительность каждого слоя к разным участкам видимого спектра. Непосредственно к пленке-носителю расположен слой, поглощающий красную, далее слой, поглощающий зеленую, и, наконец, третий наружный слой поглощает синюю часть видимого спектра.
Галогениды серебра расходуются фотопромышленностью в больших количествах. Поэтому актуальной становится регенерация серебра и отходов, разработка новых несеребряных фотоматериалов. Радикально изменило ситуацию создание цифровых фотоаппаратов, в которых регистрируемое изображение преобразуется в электрический сигнал, который с помощью компьютера преобразуется в черно-белое или цветное изображение.
Рис. 7.38. Негативное и позитивное изображение.
КОНЕЦ ДОПОЛНЕНИЯ
Среди дигалогенидов, как и следовало ожидать исходя из наиболее устойчивых степеней окисления, наибольшее значение имеют соединения меди. Известны фторид, хлорид и бромид, в то время как иодид получить не удается, по крайней мере в водном растворе из-за окисления иодид-ионов катионами Cu2+ (Сноска: Фаза CuI2 не охарактеризована методом рентгенофазового анализа. Имеются сообщения о получении фазы нестехиомтерического состава CuI1.9). Бесцветный фторид CuF2 кристаллизуется в искаженной структуре рутила , построенной из искаженных октаэдров [CuF6] объединенных вершинами. Интересно, что четыре атомы фтора в экваториальной плоскости расположены к атому меди ближе, чем находящиеся сверху и снизу, что соответствует не растяжению, а сжатию октаэдра вдоль оси z. Хлорид CuCl2 и бромид CuBr2 имеют слоистую структуру, составляенную из квадратов [CuCl4], объединенных общими ребрами в плоские ленты. Каждый атом меди дополняет свою конфигурацию до октаэдрической, взаимодействуя с атомами галогена из ближайших лент, расположенных сверху и снизу.
Безводные дигалогениды меди получают взаимодействием простых веществ, обезвоживанием гидратов нагреванием в высоком вакууме, в токе галогеноводорода, действием хлорида тионила:
85°C
CuCl2(H2O)2 + 2SOCl2 ¾¾¾® CuCl2 + 2SO2 + 4HCl
или действием хлористого (бромистого) ацетила на раствор ацетата меди в ледяной уксусной кислоте и уксусном ангидриде:
Cu(CH3COO)2 + 2CH3COCl = CuCl2 + 2(CH3CO)2O.
Бромид можно получить из хлорида по обменной реакции
3CuCl2 + 2BBr3 = 3CuBr2 + 2BCl3.
Образующийся трихлорид бора летуч и легко удаляется из сферы реакции, смещая равновесие вправо.
Хлорид и бромид меди(II) подобно многим другим соединениям меди окрашивает пламя в изумрудно-зеленый цвет. Считается, что окраска связана с переходами электронов с 3d- на 4s-орбиталь в ионе Cu+, образующимся при восстановлении меди(II) в плазме пламени. Они хорошо растворимы в воде и спиртах, ацетоне, пиридине. Из водных растворов они кристаллизуются в виде кристаллогидратов [CuF2(H2O)2], [CuCl2(H2O)2], [CuBr2(H2O)2]×2Н2О,представляющих собой цепочечные полимеры с мостиковыми атомами галогена (Рис. 7.39. Строение дигидратов CuХ2(H2O)2, X = F, Cl, Br. В структуре хлорида расстояния Cu-Cl 0.228 и 0.293 нм, а Cu-O 0.194 нм). Интересно, что в структуре хлорида и бромида тетрагонально искаженные октаэдры не вытянуты вдоль оси z, как это обычно наблюдается в комплексах меди(II), а сжаты, что вызвано крупным размером галогенид-ионов.
Благодаря одновременному присутствию в координационной сфере меди двух лигандов дигидрат хлорида меди имеет бирюзовую окраску, а при растворении в небольшом количестве воды дает зеленые растворы, в которых присутствует значительное количество смешанных аквахлоридных комплексов. Лишь при разбавлении
водой их окраска меняется на голубую за счет образования акваионов [Cu(H2O)6]2+.Если к такому ратсвору присыпать твердого хлорида натрия, окраска внось станет зеленой за счет смещения равновесия вправо:
[CuCl2(H2O)2] + 4H2O  [Cu(H2O)6]2+ + 2Cl–
[Cu(H2O)6]2+ + 2Cl–
При действии щелочей из ратсовров галогенидов могут быть получены основные соли, например, CuOHCl, Cu2(OH)3Cl, Cu2(OH)3Br.
Галогенидные комплексы меди(II) описаны в предыдущем разделе.
Среди дигалогенидов серебра и золота истинным соединением, содержащим атом металла в степени окисления +2 является фторид, образующийся при фторировании порошка монофторида в виде стального цвета кристаллов, при недостатке атомов фтора имеющих желто-коричневый цвет:
t°
2AgF + ClF3 = 2AgF2 + ClF
В структуре дифторида атомы серебра находятся в центер квадратов из атомов фтора, соединенных в плоские ленты. Антиферромагнитное взаимодействие, осуществляемое при участии р-орбиталей атомов фтора, приводит ктому. Что магнитный момент веществ оказывается ниже ожидаемого исходя из конфигурации d9. Вещество является сильным окислителем и наряду с трифторидом кобальта используется в качестве фторирующего агента в основном при синтезе перфторуглеводородов:
CH3(CH2)5CH3 + 32AgF2 = CF3(CF2)5CF3 + 32AgF + 16HF
Водой это вещество разлагается с выделением смеси кислорода и озона
6AgF2 + 3H2O = 6AgF + 6HF + O3,
а в жидком фтороводороде растворяется с частичной ионизацией. При добавлении к такой раствор сильной кислоты Льюиса, например, пентафторида сурьмы, удается выделить темно-синие кристаллы соли [AgF][SbF6], содержащие зигзагообразные цепи с линейными фрагментами F-Ag-F, по строению напоминющие моногалогениды золота. Известно также и вещество Ag[SbF6]2, в котором атом серебра находится в центре искаженного октаэдра, образованного атомами фтора (Gantar D., Leban I., Frlec B., Journ. Chem. Soc., Dalton Trans., 1987, 2379).
Кислотные свойства дифторида серебра проявляются в реакциях с типичными основаниями Льюиса – фторидами щелочных металлов. Образующиеся при их взаимодействии фтороаргентаты(II), например, K[AgF3], K2[AgF4] предсталяют собой парамагнитные вещества, разлагающиеся водой.
Дихлорид золота, образующийся в виде черных кристаллов при действии на ратсвор хлорида золота(III) в хлористом тиониле стехиометрическим количеством угарного газа, на самом деле представляет собой смешанный хлорид золота(I, III). Он построен из циклических молекул Au4Cl8, предсталяющих собой два плоских квадрата Au+3Cl4, расположенных в параллельных плоскостях и соединенных двумя атомами золота(+1) (Рис. 7.40. Строение галогенидов золота и серебра: (а) Au4Cl8, (б) Au4Cl8, (в) MF3 (M =Ag, Au), вид на цепи вдоль оси а ячейки,(г) вид на цепь сбоку вдоль наравления с).
Среди тригалогенидов наиболее важны соединения золота, соответствующие наиболее устойчивой положительной степени окисления металла.
Трифторид золота AuF3 впервые был получен при нагревании до 300°C сольвата AuF3×BrF3, образующегося при растворении золота во вториде брома(III). Также он может быть получен прямым синтезом. В вакууме при 300°C вещество возгоняется, оседая в виде золотисто-желтых игольчатых кристаллов. Каждый атом золота находится в центре квадрата, образованного атомами фтора. Отдельные квадраты соединены сторонами в спиральные цепи (Рис. в), которые благодаря слабым дополнительным взаимодействиям атомов золота с атомами фтора из соседних витков цепи, образуют длинные трубки, при виде сбоку напоминающие звезду Давида (рис. г).
Аналогичное строение имеет и красный трифторид серебра AgF3, полученный под руководством проф. Н. Бартлетта по реакции
K[AgF4] + BF3 = AgF3 + K[BF4].
Исходный тетрафтороаргентат(III) был получен фторированием смеси нитратов калия и серебра. Трифторид серебра неустойчив и даже при комнатной температуре медленно выделяет фтор, превращаясь в смешанный фторид Ag[AgF4]2 (N. Bartlett, B. Zemva, K. Lutar et al., Journ. Amer. Chem. Soc., 1991, 113, 4192; Inorg. Chem., 1995, 34, 2692). Имеются сведения о том, что он образуется при окислении серебра O2F2 при низких температурах. И в данном случае реакция проходит через стадию образованию тетрафтораргентата(III), на этот раз в виде соли оксигенила O2+[AgF4]– .
Трифторид серебра является натсолько сильным окислителем, что взаимодействует даже с ксеноном:
2AgF3 + Xe = 2AgF2 + XeF2.
Ранее был описан также нейстойчивый трифторид меди СuF3, красные кристаллы которого получают действием фтороводорода на гексафторокупрат(III) K3CuF6 при -60оС. В современной литературе сведений об этом веществе не найдено.
Хлорид и бромид золота(III) могут быть получены прямым синтезом. Для синтеза хлорида над золотом, нагретым до 240°C пропускают быстрый ток хлора. Вещество оседает в наиболее холодной зоне в виде красных кристаллов. Повышение температуры до 260°C приводит к частичному превращению продукта в монохлорид. Красно-коричневый бромид образуется при экзотермической реакции между порошком золота и жидким бромом.
Устойчивость тригалогенидов понижается от фторида к иодиду, существование которого вызывает сомнения. Это объясняется возрастанием восстановительных свойств галогенид-иона, встпающего с атомом золота(III) во внутримолекулярную окислительно-восстановительную реакцию.
Хлорид и бромид золота(III) в твердом виде и в парах состоят из димеров Au2X6, представляющих собой два плоских квадрта, соединенные общей стороной (Рис. б). При растворении в воде они дают красные растворы, содержащие ионы [AuХ3(OH)]–. Добавление галогеноводородной кислоты приводит к смещению равновесия в сторону тетрагалогеноауратов [AuX4]–, цвет раствора при этом меняется на желтый.
Фторид золота(III) наряду с трифторидом серебра используется как мощный фторирующий агент. Трихлорид золота служит удобным исходным веществом для синтеза различных соединений золота, в том числе золотоорганических соединений:
Au2Cl6 + 4EtMgCl = 2AuEt2Cl + 4MgCl2.
Высшие галогениды представлены лишь фторидами золота. Красно-коричневые кристаллы пентафторида AuF5 состоит из цепных полимеров [AuF6], в которых искаженные октаэдры связаны мостиковыми связями за счет цис-атомов фтора. AuF5 получают фторированием золота при помощи одного из самых мощных фторсодержащих окислителей – дифторида криптона (см. том 2, с. 333) или смеси кислорода и фтора. Процесс проводят в две стадии, на первой из которых образуется гексафтороаурат(V) оксигенила:
400°C, p
Au + O2 + 3F2 ¾¾¾® O2+[AuF6]–
который разлагают нагреванием в вакууме
O2+[AuF6]  AuF5 + O2 + ½ F2.
AuF5 + O2 + ½ F2.
Пентафторид золота представляет собой димер Au2F10 с двумя мостиковыми атомами фтора (I.-C. Hwang, K. Seppelt, Angew. Chem., Intern. Ed. Engl., 2001, 40, 3690) Соединение димагнитно, что соответствует низкоспиновой октаэдрической конфигурации d6. Это вещество является сильнейшим окислителем; окисляет дифторид ксенона
AuF5 + XeF2  XeF4 + AuF3,
XeF4 + AuF3,
воду
AuF5 + Н2O = 2HF + ½ O2 + AuF3,
воспламеняет оргнические вещества. При взаимодействии с основными фторидами оно проявляет кислотные свойства
NaF + AuF5 = Na[AuF6]
По-видимому, это соединение является более сильной кислотой, чем пентафторид сурьмы, следовательно его раствор во фтороводороде и фторсульфоновой кислоте должен по силе превосходить «магическую кислоту» (том 2, с. 220). Однако проверить это не удается из-за неустойчивости раствора AuF5: во фтороводороде он лнгко распадается на фтор и трифторид золота.
Гексафтороаураты(V) более устойчивы, чем пентафторид. Даже оксигенильная соль O2+[AuF6]– может быть перекристаллизована без разложения из жидкого фтороводорода. Их получают окислением золота или его трифторида AuF3:
2Au + 5KrF2 + 2МF = 2М[AuF6] + 5Kr.
Образующиеся желтые соли содержат октаэдры [AuF6]–.
Взаимодействием пентафторида с дифторидом ксенона в жидком фтороводороде может быть получен комплекс [ 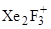 ][AuF6]–, при нагревании до 110°C разлагающийся на XeF6 и [XeF5]+[AuF6]–.
][AuF6]–, при нагревании до 110°C разлагающийся на XeF6 и [XeF5]+[AuF6]–.
Имеется сообщение о синтезе гептафторида золота AuF7 (Попов А.И., Соколов В.Б., Спирин С.Н. Докл. АН СССР, 1986, 291, 125). Он представляет собой летучее желтое кристаллическое вещество, легко разлагающееся на AuF5 и F2 и окисляющее воду с образованием Au2O3, Au и HF
При окислении пентафторида AuF5 атомарным фтором возможно образование гексафторида золота AuF6, диспропорционирующего на гепта- и пентафториды золота
2AuF6 ® AuF7 + AuF5.
Бинарные высшие фториды меди и серебра неизвестны, однако существуют комлпексные соли, в которых эти элементы находятся в степенях окисления выше +3. Подобно высшим фторидам золота, их синтез ведут только с помощью сильных окислителей – фтора или фторидов инертных газов. Комплексные фториды M2CuF6, M = Rb, Cs синтезируют, например, по реакции
2CsF + CuF2 + F2 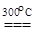 Cs2[CuF6].
Cs2[CuF6].
Структура гексафторокупрата (IV) содержит октаэдрические анионы [CuF6]2–. Магнитный момент равен 1.77 м.Б., что соответствует электронной конфигурации d 7 ( 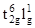 ) c одним неспаренным электроном. Соединения бурно взаимодействуют с водой, окисляют фтороводород до фтора уже при низких (-78оС) температурах (D. Kissel, R. Hoppe, Z. Anorg. Allg. Chem., 1998, 559, 40).
) c одним неспаренным электроном. Соединения бурно взаимодействуют с водой, окисляют фтороводород до фтора уже при низких (-78оС) температурах (D. Kissel, R. Hoppe, Z. Anorg. Allg. Chem., 1998, 559, 40).
При взаимодействии фторидов AgF и CsF под давлением F2 получено соединение Cs2[AgF6], которое является смешанно-валентным комплексом Ag(III) и Ag(V) Cs2 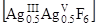 и построено из октаэдров [AgIIIF6] и [AgVF6]. При нагревании комплекс разрушается
и построено из октаэдров [AgIIIF6] и [AgVF6]. При нагревании комплекс разрушается
2Cs2[AgF6] = 2Cs[AgF4] + 2CsF.
Дата добавления: 2016-01-03; просмотров: 1700;
