Дополнение. Разнообразие ванадатов.
(Сноска: При написании этого раздела использована курсовая работа студента Химического факультета МГУ Громова Александра. Авторы выражают ему благодарность). Отличительная особенность химии водных растворов ванадия в высшей степени окисления заключается в способности образовывать различные изополисоединения. В табл. 3.5 перечислены изополиоксованадаты, которые были выделены в виде кристаллических солей. Координационные числа ванадия в этих анионах 4 - 6.
Таблица 3.5.
Анионы ванадия (V), ванадия (IV) и со смешанной валентностью, полученные из водных и неводных растворов
| Формула | Координационное число ванадия | Катионы и изополиванадаты | |
| [VO4]3- | K; Na(•2H2O); Ag↓; Sr; Ba; Al(•3H2O); Sc; Ln; Bi; Fe(III); Cu(II)(•3H2O) | ||
| [V2O7]4- | Ca(•2H2O); NH4; Na; K; Zr; Ag↓ | ||
| (VO3-)¥ | 4; 5 | K(•H2O); Na(•1,89H2O); Ca(•2H2O);Sr(•4H2O); (КЧ=5) | K; Na; NH4; Tl; (КЧ =4) |
| [V4O12]4- | n-Bu4N; t-BuNH3 | ||
| [V10O28]6- | Na; K/Zn(•16H2O); K/Mn(•16H2O); Ca(•17H2O); Na/Mg(•24H2O); K/Mg(•16H2O); NH4; Cs. | ||
| [V18O42]12- | Ba; Tl; Cs; Rb; Na/Cs; Na(•24H2O); K(•16H2O) | ||
| [V19O49]9- | 4; 5; 6 | K(•11H2O) | |
| [V10O26]4- | 4; 5 | Me4N | |
| [V3O8]2- | 4; 5 | NH4(•0,5H2O); К | |
| (V3O8-)¥ | 5; 6 | NH4; K; Rb; Cs; Na | |
| (V5O143-)¥ | 4; 5 | К | |
| [V5O14]3- | n-Bu4N |
Структурная химия этих соединений достаточно сложна. В кристаллических солях ионы VO43- и V2O74- содержат тетраэдрически координированные атомы металла. Например: K3VO4, Na3VO4•2H2O, ZrV2O7 и т.д. Диванадат в растворе по структуре аналогичен дифосфату P2O74-.
При рН 7 – 10 в водных растворах преобладают бесцветные метаванадаты в форме тримерных и тетрамерных анионов. При кристаллизации из таких растворов чаще всего выделяются соли, содержащие бесконечные цепи тетраэдров VO4 (KVO3, NaVO3, NH4VO3 и TlVO3,(рис. 3.16 в), или искаженных тригональных бипирамид VO5 ( KVO3•H2O, NaVO3•1,89Н2O, Ca(VO3)2•2Н2O и Sr(VO3)2•4H2O, рис. 3.16 г). Так, например, при растворении ванадиевого ангидрида в растворе гидроксида натрия при рН = 10 образуется метаванадат, кристаллизующийся в форме гидрата NaVO3×H2O. Безводные метаванадаты щелочных металлов получают сплавлением:
t°C
Na2CO3 + V2O5 = 2NaVO3 + CO2
Кристаллических три- и тетраванадатов известно гораздо меньше. Примером может служить соль (t-BuNH3)4[V4O12], выделенная из раствора оксида ванадия(V) в трет-бутиламине при рН 10.4 (P. Roman, A. S. Jose, A. Luque, J.M. Gutierrez-Zorilla, Inorg. Chem., 1993, 32, 775). Кристаллическая структура этой соли содержит циклический анион, состоящий из соединенных вершинами тетраэдров VO4 (Рис. 3.23 Строение некоторых изополи- и гетерополиванадатов (а) V4O124–, (б) V5O143–, (в) V10O264–, (г) [MnV13O38]7–).
Подкисление растворов метаванадатов до рН 7 или ниже ведет к образованию оранжевых растворов, содержащих анион декаванадата [V10O28]6- (Рис. 3.15). После нагревания или старения растворов, содержащих ион декаванадата, можно выделить темно-красные кристаллы триванадата. Эти соли имеют эмпирическую формулу MV3O8 (М = NH4, К, Rb, Cs), но иногда их записывают как M2V6O16 и называют в литературе гексаванадатами. Калиевые и цезиевые триванадаты содержат бесконечные вытянутые слои полиэдров VO5 и VO6. Другой полимерный анион содержится в желтой соли K3V5O14, которая также осаждается из водного раствора. Структура этого аниона может быть представлена как бесконечные слои соединенных вершинами квадратных пирамид VO5 и тетраэдров VO4. Структура аниона в водном растворе соли [(n-C4H9)4N]3[V5O14] представлена на рис. (рис. 3.23 б).
При окислении персульфатом калия сульфата марганца(II), растворенного в подкисленном растворе ванадата, образуется оранжево-красный 13-ванадоманганат(IV) K7[MnV13O38] – гетерополисоединение со структурой Андерсона (рис. 3.23 г). Ионы [MnV13O38]7– стабильны в водном растворе при рН 3 – 6, в более кислой среде устойчив анион [MnV11O32]5–. Синтезировано большое число и других гетерополиванадатов, содержащих атомы никеля, кобальта, алюминия, кремния, фосфора.
КОНЕЦ ДОПОЛНЕНИЯ
О химии водных растворов соединений ниобия и тантала известно гораздо меньше. При нейтрализации щелочами водных растворов пентагалогенидов ниобия и тантала образуются студенистые белые осадки гидратированных оксидов M2O5×xH2O, состав которых зависит от условий проведения опыта. При их хранении или нагревании протекают процессы оляции и оксоляции, аналогичные описанным для титановых кислот. Дегидратация заканчивается образованием оксида M2O5. Сплавление оксидов с щелочами или карбонатами приводит к ниобатам и танталатам, например, NaМO3, NaМ3O8, Na2М4O11, Na3МO4, Na5МO5, Na2M8O21 (M = Nb, Ta), в которых атом ниобия или тантала находится в центре кислородного октаэдра (Сноска: исключение составляют соединения скандия и РЗЭ, содержащие изолированные анионы ортоформы: ScNbO4, а также соли типа Na5MO5, в которых атом металла находится внутри искаженной тригональной бипирамиды из атомов кислорода).
Например, метаниобаты натрия и калия МNbO3 имеют структуру перовскита. В ортониобате натрия Na3NbO4 октаэдры NbO6 связаны друг с другом четырьмя общими ребрами в ионы Nb4O1612–, а в пустотах между ними находятся атомы натрия. При выщелачивании плава водой ниобаты и танталаты переходят в раствор, в зависимости от рН образуя различные оксо- и гидроксо-анионы. Так, в сильно щелочных средах преобладают моноядерные ионы [МO2(OH)4]3– с координационным числом шесть, которые при понижении кислотности среды объединяются в шестиядерные изополианионы [М6O19]8–, образованные из шести октаэдров МО6, сочлененных общими ребрами в единый октаэдр (Рис. 3.24. Строение [М6O19]8– (М = Nb, Та)):
6NbO43- + 10 H+ = Nb6O19 8- + 5H2O (необратимо),
Они способны сохранять устойчивость, присоединяя от одного до трех протонов, последующее подкисление (до рН = 5 в случае ниобия и рН = 10 в случае тантала) приводит к осаждению гидратированных оксидо:
pH ≈12 Nb6О19 8- + H+  HNb6O19.xH2O7-
HNb6O19.xH2O7-
pH ≈ 9 HNb6O197- + H+  Nb6O186- + H2O
Nb6O186- + H2O
pH ≈ 4,5 Nb6O186- + 6H+ + xH2O = H6Nb6O18.xH2O (Nb2O5.xH2O) (необратимо).
При прокаливании изополиниобаты и танталаты переходят в метаформу:
K8Nb6O19×12H2O = 6KNbO3 + 2KOH + 11H2O.
В сернокислых растворах ниобатов при концентрации 10-2 М присутствуют комплексы [NbO(SO4)2]- и [NbO2(SO4)]-. Действие на такие растворы металлического цинка приводит к красно-коричневому раствору, в котором происходит чатсичное восстановлением ниобия до +4.
Сплавлением оксидов ниобия и тантала с пиросульфатом калия могут быть получены многочисленные оксосульфаты, например, Nb2O4SO4, Nb2O3(SO4)2, Nb2O2(SO4)3, Nb2O(SO4)4, или двойные соли, K7Nb(SO4)6. При нагревании они разлагаются на Nb2O5 и SO3. Реакция между пентахлоридами ниобия и тантала и диоксидом азота приводит к оксонитратам MO(NO3)3. В присутствии воды все эти вещества мгновенно подвергаются необратимому гидролизу до гидратированного оксида.
При взаимодействии бензольных растворов пентахлоридов ниобия и тантала с алкоголятами щелочных металлов или спиртами в присутствии аммиака образуются алкоксиды M(OR)5 – бесцветные легколетучие твердые вещества, хорошо растворимые в воде и устойчивые в паре, благодаря слабому p-перекрыванию заполненных р-орбиталей атомов кислорода с вакантными d-орбиталями атома металла. Эти вещества легко гидролизуются водой, превращаясь в гидратированные оксиды, благодаря чему находят применение для нанесения оксидных покрытий золь-гель методом. Реакция между пентахлоридами и дикетонами даже в присутствии сильных оснований не позволяет заместить более четырех атомов хлора. Образующийся при этом комплекс, например, M(acac)2Cl, где acac – анион ацетилацетона, также обладает высокой летучестью.
При электролизе сернокислых растворов соединений ниобия(V) происходит восстановление ниобия до низших степеней окисления. Из образующегося красно-коричневого раствора при добавлении сульфата калия были выделены кристаллы сульфатного комплекса ниобия [K4(H5O2)][Nb3O2(SO4)6(H2O)3]·5H2O. В комплексном анионе атомы ниобия связаны друг с другом как непосредственно (Nb–Nb 0.269 нм), так и при помощи двух атомов кислорода, выступающих в роли тридентатных лигандов, и шести мостиковых η2-сульфатных групп:
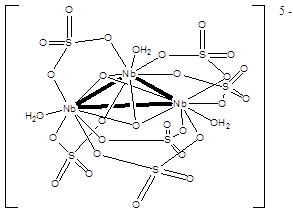
Средняя степень окисления ниобия в этом соединении равна +3,67. В настоящее время известно несколько таких солей с разными катионами (A. Bino, J. Amer.Chem.Soc., 1980, 102, 7990; F. A. Cotton, M.P. Diebold, W.J. Roth, Inorg. Chem., 1988, 27, 2347). Аналогичное строение имеет и ацетат ниобия [Nb3O2(CH3COO)6(thf)3](CH3COO), полученный из хлорида ниобия(III) и ацетата натрия в тетрагидрофуране.
В отсутствии анионов, способных выступать в роли лигандов, в растворах, полученных действием сильных восстановителей (водород в момент выделения) на подкисленные растворы ниобатов, по-видимому, присутствуют смешанные ионы ниобия(III) и ниобия(IV) общей формулы [Nb3O4(H2O)9]n+. При повышении рН из таких ратсворов выделяется серо-синий осадок оксогидроксида, со временем обесцвечивающийся вследствие окисления кислородом воздуха. Информация о составе и строении низших гидроксоксидов ниобия отсутствует.
Танталаты(V) в этих условиях не восстанавливаются, что позволяет сделать вывод об ослаблении окислительной способности соединений в высшей степени окисления при движении вниз по группе.
Дата добавления: 2016-01-03; просмотров: 1960;
