ДОПОЛНЕНИЕ Галогенидные кластеры ниобия и тантала
Тетрагалогениды и низшие галогениды ниобия и тантала, в отличие от аналогичных соединений ванадия, содержат связи металл-металл, то есть относятся к кластерам. В тетрагалогенидах, построенных из бесконечных одномерных цепей из сочлененных ребрами октаэдров NbCl6, атомы металла внутри цепей попарно сдвинуты из центров тяжести октаэдров друг к другу с образованием димерных группировок [Nb2Cl8] со связями Nb-Nb типа dσ-dσ (на образование связей металл-металл указывает диамагнетизм соединения). Октаэдры NbCl6 дополнительно связаны друг с другом галогенидными мостиками:
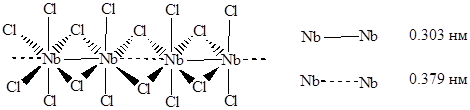
Их получают восстановлением высших галогенидов водородом или ниобием (танталом):
2NbCl5 + H2 = 2NbCl4 + 2HCl.
Тетрагалогениды представляют собой сильно гигроскопичные порошки, разлагающиеся водой с образованием неустойчивых синих растворов, предположительно, содержащих ионы [M3O4(H2O)n]4+. При нагревании тетрахлориды диспропорционируют:
2МCl4 = МCl3 + МCl5↑.
Низшие галогениды ниобия и тантала, образующиеся при восстановлении пентагалогенидов натрием или алюминием, имеют формулы, не соответствующие простейшим представлениям о валентности. В структуре веществ, условно называемых тригалогенидами, атомы галогена образуют плотнейшую гексагональную упаковку, в которой половина октаэдрических пустот заполнена атомами металла. Это соответствует составу М3Х8, где М = Nb, Ta, а Х – галоген. Атомы М соединены друг с другом в тройки связями металл-металл (Рис. 3.30 (а) Строение Nb3Cl8). При более полном восстановлении образуются вещества, содержащие кластеры [M6X12]n+, в которых атомы металла прочно связаны друг с другом в октаэдры, а над каждым ребром октаэдра находится мостиковый μ2-атом галогена (рис. 4.30 (б, в) Строение кластера [M6X12]n+ (М = Nb, Та)). Отдельные октаэдры связаны друг с другом общими атомами галогена. В зависимости от числа таких связок образуются галогениды различного состава, например, М6Х15 или [M6X12]Х3 (соответствует МХ2.5), М6Х14 или [M6X12]Х2 (соответствует МХ2.3). В иодиде ниобия Nb6I11 (соответствует NbI1.83) октаэдр из атомов ниобия находится в центре куба, образованного атомами иода (Рис. 4.30 (г)Структура иодида ниобия Nb6I11).
Интересно, что многие из этих веществ не только не разрушаются водой, но и хорошо в ней растворимы. При этом содержащиеся в них кластерные ионы переходят в раствор без изменений. Так, например, хлорид Ta6Cl14 при кристаллизации из раствора выделяется в виде гидрата. Из его водного раствора ионами серебра удается осадить лишь атомы хлора, не входящие в кластер Ta6Cl14∙8H2O. При окислении этого соединения иодом образуются желтый раствор хлорида [Ta6Cl12]Cl3, а при действии более сильных окислителей (хлора, пероксида водорода) – красно-коричневый раствор, содержащий ионы [Ta6Cl12]4+. Эти соединения, в свою очередь, могут быть восстановлены в подкисленном водном растворе ванадием(II) или хромом(II) без изменения состава кластера:
0.83 B 1.12 B
[Nb6Cl12]2+ ¾® [Nb6Cl12]3+ ¾® [Nb6Cl12]4+
зеленый желтый красно-коричневый,
0.49 B 0.83 B
[Ta6Cl12]2+ ¾® [Ta6Cl12]3+ ¾® [Ta6Cl12]4+
зеленый желтый красно-коричневый.
КОНЕЦ ДОПОЛНЕНИЯ
Дата добавления: 2016-01-03; просмотров: 2047;
