ДОПОЛНЕНИЕ Металлорганические соединения элементов шестой группы
В низших степенях окисления (-2, -1, 0) хром, молибден и вольфрам образуют соединения с p-акцепторными лигандами, например, циклопентадиенилом p5-  , бензолом p6-С6Н6, а также угарным газом СО.
, бензолом p6-С6Н6, а также угарным газом СО.
Гексакарбонилы М(СО)6 представляют собой бесцветные летучие кристаллические вещества, имеющие молекулярное строение. Карбонилы сильно ядовиты. Молекулы М(СО)6 диамагнитны и имеют форму октаэдра, в центре которого находится атом металла.
Карбонилы металлов группы хрома не удается получить при взаимодействии простых веществ с оксидом углерода. Исходными веществами для их синтеза служат галогениды, например,
WCl6 + 3Fe + 6CO 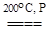 W(CO)6 + 3FeCl2.
W(CO)6 + 3FeCl2.
.При температуре выше 200 оС карбонилы разлагаются
М(СО)6  М + 6СО,
М + 6СО,
что используют для нанесения металлических покрытий. Гексакарбонил вольфрама катализирует метатезис олефинов.
В ареновых комплексах, – хромоцене Cr(С5Н5)2 и дибензолхроме Cr(С6Н6)2, атом металла находится между двумя параллельно расположенными циклическими молекулами с сопряженными двойными связями (рис. 5.8 а; Рис. 5.8. Металлорганические соединения металлов группы хрома: (а) дибензолхром, (б) хромоцен, (в) гидридый комплекс хромоцена Cr(С5Н5)2Н2, (г) [(CO)5Мо–H–Mо(CO)5]). Такие соединения получили название сэндвичевых структур. Связь металл – лиганд осуществляется не только за счет перекрывания заполненных молекулярных орбиталей лиганда с незаполненными атомными орбиталями хрома, но и за счет взаимодействия АО хрома с вакантными МО лиганда. Это объясняет высокую прочность химической связи и термодинамическую устойчивость металлоценов.
Хромоцен Cr(С5Н5)2 получают взаимодействием хлорида хрома и натриевого производного циклопентадиена в тетрагидрофуране.
2Na[C5H5] + CrCl2 =Cr(C5H5)2 + 2NaCl.
Из раствора вещество выделяется в форме красных кристаллов, изоморфных ферроцену, но в отличие от него, парамагнитных и легко окисляющихся на воздухе.
При действии тетрагидробората натрия они превращаются в желтый гидридный комплекс Cr(С5Н5)2Н2 с клинообразной сэндвичевой структурой (рис.5.8 в). При низкотемпературном фотохимическом разложении образуются неустойчивые мономерные молибдо- и вольфрамоцены М(С5Н5)2, которые выше 10 К превращаются в красно-коричневые полимеры [М(С5Н5)2]n.
Среди металлоценов наиболее устойчив дибензолхром Cr(С6Н6)2 – кристаллическое вещество темно-коричневого цвета, образующееся при взаимодействии безводного хлорида хрома(III) с бензолом в присутствии катализатора AlCl3 и алюминиевой пудры, необходимой для восстановления хрома и связывания хлорид-ионов
CrCl3 + 2C6H6 + Al =Cr(C6H6)2 + AlCl3.
Дибензолхром хорошо растворяется в органических растворителях, легко возгоняется, а при нагревании разлагается с выделением хрома, что используется для получения металлических покрытий. Аналогичным образом получают кристаллические зеленый Мо(С6Н6)2 и желто-зеленый W(C6H6)2. Дибензолцены металлов шестой группы изоэлектронны ферроцену, но менее устойчивы.
Димерные ионы [M2(CO)10]2-, в которых степень окисления металла равна -1, образуются при восстановлении гексакарбонилов [M(CO)6] борогидридом Na[ВН4] в жидком аммиаке
M(CO)6+ NaВН4  Na2[M2(CO)5].
Na2[M2(CO)5].
Продуктами их гидролиза являются желтые гидриды [(CO)5M–H–M(CO)5], в которых атомы металла соединены между собой кратной связью М═М и трехцентровыми двухэлектронными связями М–Н–М (рис.5.8 г).
Восстановление гексакарбонилов М(СО)6 металлическим натрием в жидком аммиаке приводит к образованию анионных карбонильных комплексов, в которых атом металла находится в отрицательных степенях окисления: Na2[Cr-2-(CO)5] и
Na4[Cr-4-(CO)4].
КОНЕЦ ДОПОЛНЕНИЯ
Соединения хрома, молибдена и вольфрама +3.
Данная степень окисления наиболее характерна для хрома, поэтому основное внимание в данном разделе уделено химии хрома. Соединения молибдена(III) являются сильными восстановителями и гораздо хуже изучены, а вольфрама(III) – практически неизвестны.
В водных растворах соединения хрома(III) обладают высокой окислительно-восстановительной устойчивостью как в кислой, так и в щелочной среде (рис. 5.1), что может быть объяснено высокими значениями ЭСКП для конфигурации d3 в октаэдре: как потеря, так и преобретение электрона неизбежно приводят к уменьшению ее величины, а, соответственно, и понижению термодинамической устойчивости. Наличие трех неспаренных электронов обусловливает парамагнетизм соединений Cr(III), большинство из которых интенсивно окрашено. Помимо этого, октаэдрические комплексы, в которых отсутствуют вакантные t2g орбитали, а eg-орбитали остаются незаполненными, являются инертными. Такие соединения реагируют с очень низкой скоростью. Например, скорость обмена воды в ионе [Cr(H2O)6]3+ при 25 °C составляет 4,5×10–7 с–1. Таким образом, соединения хрома(III) в водных растворах выгодно сочетают в себе термодинамическую и кинетическую устойчивость. В этом отношении они прямо противоположны соединениям хрома(II), которые кинетически лабильны и, кроме того, являются сильными восстановителями.
Солянокислый раствор хлорида хрома(II) на воздухе мгновенно окисляется и меняет окраску, становясь из ярко-синего темно-зеленым. При упаривании и охлаждении из него выделяются изумрудно-зеленые кристаллы гексагидрата. Нитрат серебра способен осадить лишь одну треть содержащегося в них хлора, что доказывает вхождение двух из трех атомов хлора в состав внутренней координационной сферы: [Cr(H2O)4Cl2]Cl×2H2O. Если долго кипятить разбавленный раствор этой соли, а затем охладить его до 0 °C и насытить хлороводородом, то цвет раствора станет фиолетовым, и из него выделятся сине-фиолетовые кристаллы такого же состава, что и исходная соль. При помощи нитрата серебра из этого вещества удается осадить весь хлор, что позволяет приписать ему формулу [Cr(H2O)6]Cl3. Раствор хлорида гексааквахрома(III) в холодной воде окрашен в фиолетовый цвет, однако при кипячении он изменяет окраску, становясь темно-зеленым. Таким образом, в зависимости от условий хлорид хрома(III) может быть выделен из раствора в виде двух изомеров с различным составом внутренней координационной сферы. В растворе оба иона находятся друг с другом в равновесии:
[Cr(H2O)6]3+ + 2Cl–  [Cr(H2O)4Cl2]2+ + 2H2O,
[Cr(H2O)4Cl2]2+ + 2H2O,
положение которого зависит от температуры и концентрации ионов хрома. Например, при 25 °C в 20%-ном растворе хлорида хрома 93% ионов хрома присутствует в форме гексаакваионов, а в 57 %-ном - только 60%. Нагревание смещает равновесие вправо: при 84 °C в 57%-ном растворе концентрация гексаакваионов снижается до 48%. Аналогичные равновесия имеют место и в растворах всех других солей, однако их скорость настолько велика, что удается выделить только один из изомеров, образующий наиболее устойчивую кристаллическую решетку и поэтому имеющий наименьшую растворимость. В случае солей хрома, а также инертных комплексов других металлов (кобальта(III), родия(III), платины(II)), удается выделить все возможные изомеры по причине того, что скорость реакции изомеризации крайне низкая. Гидратная изомерия свойственна большинству солей хрома(III). При этом во всех случаях cоли, содержащие ионы гексакаквахрома(III), имеют сине-фиолетовую окраску, а соли, в которых во внутреннюю координационную сферу входят также и анионы, – зеленые или красные (Рис. 5.9. Гидраты хлорида хрома(III)).
Ион [Cr(H2O)6]3+ поглощает свет в красной (n1 = 17400 см-1), голубой (n2 = 24500 см-1) частях видимого спектра, а также в ближнем ультрафиолете ((n3 = = 37800 см-1), и, следовательно, имеет фиолетовую окраску (Рис. главы 2. (а) Спектр поглощения иона [Cr(H2O)6]3+, (б) расщепление терма 4F). Это объясняется тем, что в октаэдрическом поле лигандов терм 4F, соответствующий основному состоянию иона d3 расщепляется на A2g и T1g составляющие. Переходам между состояниями с одинаковой мультиплетностью соответствуют три полосы в спектре поглощения (раздел 1.2 Учебника) или три электронных перехода  ® 4T2g,
® 4T2g,  ® 4T1g и
® 4T1g и  ® 4T1g с частотами n1, n2 и n3 соответственно. Ионы гексааквахрома(III) обладают дихроизмом, то есть имеют различную окраску в проходящем (красно-фиолетовые) и отраженном (сине-фиолетовые) свете.
® 4T1g с частотами n1, n2 и n3 соответственно. Ионы гексааквахрома(III) обладают дихроизмом, то есть имеют различную окраску в проходящем (красно-фиолетовые) и отраженном (сине-фиолетовые) свете.
Нитрат хрома(III) Cr(NO3)3×9H2O, образующийся при растворении гидроксида в азотной кислоте, представляет собой призматические красно-фиолетовые кристаллы. При кипячении фиолетовый раствор нитрата хрома(III) становится зеленым, однако при охлаждении прежняя окраска возвращается. Безводный нитрат хрома(III) получают взаимодействием гексакарбонила хрома с азотным ангидридом. При действии на растворы солей хрома гидрофосфатом натрия образуется фиолетовый осадок ортофосфата CrPO4×6H2O, который под действием соды или щелочи превращается в зеленую основную соль. При нагревании гексагидрат частично обезвоживается, превращаясь в зеленую соль CrPO4×2H2O, а затем в черный порошок CrPO4, нерастворимый даже в царской водке и устойчивый вплоть до 1800 °C. При сплавлении с метафосфорной кислотой он превращается в зеленый метафосфат Cr(PO3)3, также очень устойчивый. Среди сульфатов хрома(III) также известны гидраты, имеющие фиолетовую и зеелную окраску. Фиолетовая соль [Cr(H2O)6]2(SO4)3×6H2O может быть получена при взаимодействии гидроксида хром(III) с серной кислотой, при восстановлении хромового ангидрида этанолом в сернокислой среде, при обработке хлорида гексааквахрома(III) концентрированной серной кислотой. При кипячении растворы сульфатов приобретают зеленую окраску, и из них могут быть выделены соли, в которых сульфат входит во внутреннюю координационную сферу, например, Cr2(H2O)3(SO4)3. При дальнейшем обезвоживании (нагревание до 400 °C или в токе углекислого газа до 280 °C) они переходят в розовый безводный сульфат Cr2(SО4)3, растворимый в воде только в присутствии ионов хрома(II).
При взаимодействии свежеосажденного гидроксида хрома(III) со щавелевой кислотой, при восстановлении хромового ангидрида щавелевой кислотой и ли при взаимодействии солей хрома(III) с растворимыми оксалатами образуются гидраты оксалата хрома(III) Cr2(C2O4)3×nH2O, цвет, строение и растворимость которых зависят от гидратного состава. Гексагидрат Cr2(C2O4)3×6H2O представляет собой темно-красные очень гигроскопичные кристаллы, хорошо растворимые не только в воде, но также в спирте и эфире. Их получают восстановлением хрмоового ангидрида щавелевой кислотой, взятой в избытке. При нагревании до 125 ºС это вещество теряет воду, превращаясь в нерастворимый зеленый порошок. В избытке оксалат-ионов образуются оксалатные комплексы, например, K3[Cr(C2O4)3] (рКуст = –15.4). Калиевую соль обычно получают восстановлением дихромата калия смесью щавелевой кислоты и оксалата калия:
K2Cr2O7 + 2K2C2O4 + 7H2C2O4 = 2K3[Cr(C2O4)3] + 3CO2 + 7H2O.
При охлаждении из раствора соль выделяется в виде темно-зеленых, почти черных кристаллов, в тонком слое на просвет кажущихся фиолетовыми. Способность вещества обладать различной окраской в отраженном и проходящем свете называется дихроизмом. Трисоксалатохромат(III) ион образует оптические изомеры, но выделяющиеся кристаллы оптически неактивны, так как представляют собой рацемическую смесь. Ее удается разделить на D- и L-изомеры дробной кристаллизацией солей с объемными оптически активными катионами, например, стрихнином или [Ni(phen)3]2+.
При восстановлении дихромата калия щавелевой кислотой в молярном отношении 1 : 7 образуется темно-красный раствор, из которого кристаллизуются пурпурно-красные кристаллы транс-изомера:
K2Cr2O7 + 7H2C2O4 = 2K[Cr(C2O4)2(H2O)2] + 3CO2 + 7H2O.
В растворе цис- и транс-формы существуют в равновесии, которое в слабокислых растворах смещено в сторону цис-изомера:
цис-[Cr(C2O4)2(H2O)2]– Û транс-[Cr(C2O4)2(H2O)2] –, К = 0,17 (рН = 3 – 4).
В то же время, состав выделяющейся твердой фазы соответствует транс-форме – она плохо растворима в воде и легко выпадает в осадок. Калиевая соль цис-изомера лилового цвета, обладающая прекрасной растворимостью, может быть получена при медленном охлаждении концентрированного раствора или при проведении синтеза в предельно малом количестве воды. При длительном хранении или при нагревании растворы бисоксалатохроматов меняют цвет, становясь сине-зелеными, из них кристаллизуются трисоксалатохроматы. При обработке K[Cr(C2O4)2(H2O)2] водным раствором аммиака одна из молекул воды замещается на гидрокси-группу, а в избытке щелочи образуются дигидроксикомплексы K3[Cr(C2O4)2(OH)2]. Все они существуют в виде цис- и транс-изомеров.
Среди солей хрома(III) большое распространение имеют квасцы – двойные сульфаты хрома(III) и щелочных металлов. Хромокалиевые квасцы KCr(SO4)2×12H2O, наряду с алюмокалиевыми, находят применение при дублении кож, в качестве протравы при крашении тканей. Исходным веществом для их получения является дихромат калия. При восстановлении сернистым газом или этиловым спиртом раствора этой соли, подкисленного серной кислой, образуется фиолетовый раствор, из которого при охлаждении выделяются темно-фиолетовые кристаллы хромокалиевых квасцов:
K2Cr2O7 + 3SO2 + H2SO4 + 11H2O = 2 KCr(SO4)2×12H2O¯,
K2Cr2O7 + 3C2H5OH + 4H2SO4 + 17H2O = 2KCr(SO4)2×12H2O¯+ 3CH3CHO.
В них содержатся ионы гексааквахрома [Cr(H2O)6]3+, которые и придают им фиолетовую окраску. При кипячении раствора квасцов фиолетовая окраска сменяется зеленой, и при охлаждении раствора не восстанавливается, а рН раствора понижается. Все это свидетельствует о том, что замещение координированных молекул воды на анионы кислотных остатков может сопровождаться процессами гидролиза. На первой стадии происходит депротонирование координированной молекулы воды:
[Cr(H2O)6]3+ + H2O  [Cr(H2O)5(OH)]2+ + H3O+
[Cr(H2O)5(OH)]2+ + H3O+
В случае иона гексааквахрома(III) константа равновесия этого процесса при 25 °C равна 1,6×10–4, т.е. гексаакваион оказывается такой же сильной кислотой, как муравьиная, и на порядок сильнее, чем уксусная. По этой причине водные растворы солей хрома(III) с анионами сильных кислот оказываются сильнокислыми, что препятствует дальнейшему гидролизу.
При кипячении растворов гидролиз усиливается: ионы [Cr(H2O)5(OH)]2+ посредством мостиковых ОН-групп объединяются друг с другом в полиядерные частицы,которые захватывают анионы кислотных остатков, находящиеся в растворе (Рис. 5.10.. Строение диядерного гидроксокомплекса). Это может быть представлено следующими равновесиями:
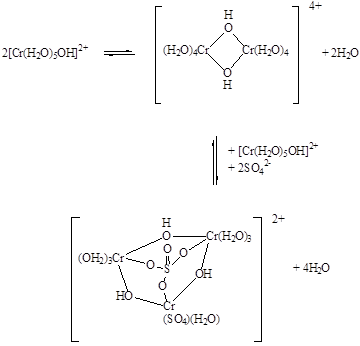
Продуктами гидролиза хромокалиевых квасцов являются двойные основные сульфаты хрома(III) и калия, например, KCr3(SO4)2(OH)6, изоструктурный мнералу алуниту, образующемуся при гидролизе алюмокалиевых квасцов, а в природе формирующемуся в вулканических областях при воздействии сернокислотных растворов на калиевые полевые шпаты. В нем атом металла(III) находится в центре октаэдра, образованного атомами кислорода сульфатных групп и молекул воды (Рис. 5.11. Координационное окружение атома хрома в хромокалиевых квасцах (а) и продукте их гидролиза (б)). По донорной активности по отношению к катиону Cr3+ анионы располагаются в следующий ряд: ClO4– < NO3– < Cl– < SO42– < HCOO– < CH3COO– < C2O42–. При гидролизе перхлората хрома(III) в растворе присутствуют катионы, в состав которых не входят перхлоратные группы:
2Cr3+ + 4H2O = [Cr3(OH)4]5+ + 4H+, pK = 8.7
4Cr3+ + 6H2O = [Cr4(OH)6]6+ + 6H+, pK = 13.9
На основании спектральных данных высказаны предположения о наличии в растворах еще более сложных катионов вплоть до [Cr12(OH)28(H2O)12]8+ (Drlijaca, L. Spiccia, Polyhedron,15, 2875; R. A. Kydd, et al, J. Chem. Soc., Dalton Tans., 1993, 2415). Обратите внимание, что в механизме гидролиза трехзарядных катионов металлов имеется много общего, недаром многие продукты гидролиза солей хрома и алюминия имеют одинаковую структуру.
Добавление щелочных реагентов (NH3×H2O, Na2CO3, NaOH) сильно ускоряет процесс гидролиза и приводит к образованию грязно-фиолетового осадка гидратированного оксида Cr2O3×xH2O, называемого иногда «гидроксидом хрома(III)». Чтобы получить хорошо сформированный осадок, осадитель надо добавлять постепенно при сильном перемешивании раствора.
Первоначально образующийся продукт отвечает составу Cr(H2O)3(OH)3 и представляет собой полимер, состоящий из октаэдрCr(H2O)(OH)5, соединенных общими ребрами в цепи:
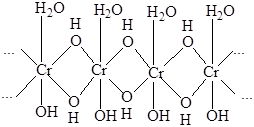
Две трети молекул воды, содержащихся в этом веществе, является внешнесферной, не связанной с атомами хрома. (Сноска: Если осаждение вести из растворов солей хрома(III), окрашенных в зеленый цвет, образуется грязно-зеленый осадок гидроксида, содержащий также анионы солей, присутствующих в растворе и координированных атомами хрома). При стоянии осадок гидроксида подвергается старению, заключающемуся в постепенной дегидратации за счет превращения гидроксомостиков в оксо-мостики. На первой стадии он теряет внешнесферную воду, приобретая состав Cr(OH)3, соответствующий структуре гидраргилита (см. гл. 4, т. 2). С течением времени он переходит в зеленый порошок оксогидроксида CrOOH со слоистой структурой (пигмент «хромовый зеленый» или «изумрудный зеленый»). Полное обезвоживание происходит при 430 °C.
Таким образом, из водных растворов нельзя получить соли хрома (III) с анионами слабых кислот, например, Cr2(CO3)3, Cr2S3 и т.д. Действительно, взаимодействие кислых растворов солей хрома(III) и щелочных растворов карбоната или сульфида, или сульфита натрия приводит к взаимному усилению гидролиза и выпадению осадка гидроксида:
CrCl3+ 3Na2CO3 + 3H2O = 2Cr(OH)3¯ + 3CO2 + 6NaCl.
Карбонат хрома(III) неизвестен, однако в гидротермальных условиях могут быть получены двойные соли, например, MgCr(CO3)2×H2O. Природный минерал барбертонит представляет собой основной карбонат хрома(III)-магния Mg6Cr2(CO3)(OH)16.4Н2О. При смешении растворов солей хрома(III) и раствормиых силикатов образуются зеленые осадки переменного состава, содержащие некоторое количество силикат-ионов. Средние силикаты хрома(III) неизвестны, хотя их двойные соли встречаются в природе в виде минералов, например, риландит (Cr, Al)6SiO11×5H2O. Один из гранатов – уваровит, названный в честь президента Российской Академии наук графа С.С. Уварова, представляет собой силикат хрома(III)-кальция Ca3Cr2(SiO4)3. В отличие от альмандина или пиропа, этот камень имеет ярко-зеленый цвет. Имеется американский патент (Klotz M., 4,740,651 US (1988)) на синтез гидрата силиката хрома состава Cr2O3×SiO2×H2O.
При действии на растворы солей хрома(III) ацетатом натрия образуются зеленые растворы, содержащие циклические трехядерные оксоацетат-ионы, построенные аналогично оксоацетатам других трехвалентных металлов (Рис 5.12. Оксо- и гидроксоацетаты хрома(III): (а) [Cr3O(CH3COO)6(H2O)3]+ в тетрафенилборате, (б) Cr8(OH)12(CH3COO)12). В твердом виде выделен [Cr3O(CH3COO)6(H2O)3]CH3COO – темно-зеленые призматические кристаллы, хорошо растворимые в воде. Аналогичное строение имеют и другие карбоксилаты. В их молекулах наиболее лабильна координированная вода, которая при перекристаллизации соли из донорного растворителя может бытб заменена на растворитель – пиридин или диметилсульфоксид. Структура комплекса при этом сохраняется. При окислении смеси ацетата хрома(II) и ацетатов некоторых других двухвалентных металлов (М = Mn, Co) в пиридине были получены кристаллы оксоацетатов, смешанных по металлу (R.D. Cannon, et al, J. Chem. Soc. Dalton Trans., 1993, 2005). Известны также и другие типы оксо- и гидроксоацетатов, например, [Cr3(OH)2(CH3COO)6]CH3COO, Cr12O12(CH3COO)15 , а также Cr8(OH)12(CH3COO)12, которое выделяется в виде темно-фиолетовых кристаллов при длительном кипячении водного раствора [Cr3O(CH3COO)6(H2O)3]CH3COO (M. Eshel, A. Bino, I. Felner, D. Johnston, M. Luban, L.L. Miller, Inorg. Chem., 2000, 39, 1376). Это соединение состоит из циклических молекул, образованных восемью атомами хрома, соединенными друг с другом мостиковыми гидроксилами и ацетатными группами (рис.5.12 б). Сине-фиолетовые кристаллы средней соли Cr(CH3COO)3×6H2O кристаллизуются из фиолетового раствора, полученного растворением свежеосажденного гидроксида хрома(III) в ледяной уксусной кислоте.
При нагревании хромокалиевых квасцов с избытком роданида калия и последующем упаривании раствора образуется темно-красная кристаллическая масса, содержащая гексароданохромат(III) калия K3[Cr(NCS)6]. После перекристаллизации из спирта (растворимость 106 г в 100 г спирта при 20 ºС) это вещество выделяется в виде красно-фиолетовых кристаллов, в проходящем свете кажущихся гранатовыми. Спектральными методами доказано, что роданид-ионы связаны с металлом-комплексообразователем посредством атомов азота. В присутствии аммиака происходит замещение двух тиоцианатных лигандов и образуется транс-тетрароданодиамминхромат(III) аммония NH4[Cr(NCS)4(NH3)2] – соль Рейнеке. Она представляет собой блестящие рубиново-красные кристаллы, хорошо растворимые в воде и спирте. С крупными катионами соль Рейнеке дает кристаллические осадки, поэтому ее используют для выделения из смесей аминов, аминокислот и оснований. Удобным препаративным методом получения этой соли является сплавление порошков дихромата аммония и роданида аммония. Действием на концентрированный водный раствор соли Рейнеке соляной кислотой получают кислоту Рейнеке H[Cr(NCS)4(NH3)2]. Ее удается выделить из раствора путем экстракции эфиром с последующим испарением эфирной вытяжки. Это вещество образует красные чешуйчатые кристаллы, хорошо растворимые в воде, спирте, ацетоне.
Взаимодействием гексароданохромата(III) с пентааммиакатом кобальта(III) удается получить гетеробиметаллические комплексы, в которых атомы двух металлов связаны мостиковой тиоцианатной группой:
K3[Cr(NCS)6] + [Co(NH3)5 (H2O)2](ClO4)3 = 3KClO4 + [(NCS)5Cr–NCS–Co(NH3)5] + 2H2O.
Гидроксид хрома амфотерен – он растворяется как в растворах кислот (Kb = 10–10)
Cr(OH)3 + 3H+ + 3H2O = [Cr(H2O)6]3+ ,
так и щелочей (Ka = 10–16)
Cr(OH)3 + 3ОH- = [Cr(OН)6]3-,
Быстрее всего происходит растворение свежеосажденного гидроксида; полное осаждение возможно в интервале рН 7 – 10 (D. Rai, B. M. Sass, D. A. Moore, Inorg. Chem., 1987, 26, 345). Образующиеся при растворении гидроксида в едких щелочах изумрудно-зеленые растворы содержат анионы [Cr(OH)6]3–, со временем из них кристаллизуются гидроксокомплексы, например, гексагидроксохромат(III) натрия Na3[Cr(OH)6]. У гидроксида хрома(III) основные свойства выражены сильнее кислотных, поэтому при кипячении разбавленные растворы гидроксохроматов полностью гидролизуются, и из них выпадает осадок гидроксида хрома(III). В этом состоит их отличие от алюминатов. Однако удобнее всего растворы хроматов(III) разрушать пропусканием сероводорода или углекислого газа:
2Na3[Cr(OH)6] + 6CO2 = 2Cr(OH)3¯ + 3Na2CO3 + 3H2O.
При этом за счет постепенного подкисления образуется кристаллический хорошо сформированный осадок гидроксида.
Сплавленим оксида хрома(III) с щелочами, карбонатами или оксидами получают хромиты, или оксохроматы (III) предствляющие собой сложные оксиды. Хромиты щелочных металлов MCrO2 состоят из октаэдров CrO6, объединенных общими ребрами в единый каркас, в пустотах которого расположены ионы щелочного металла (Рис. 5.13. Строение KCrO2). Многие хромиты двухвалентных металлов MII(CrO2)2 имеют структуру шпинели (см. рис. 1.21). В них атомы M(II) находятся в тетраэдрическом, а атомы Cr(III) – в октаэдрическом окружении атомов кислорода. Такое строение имеет и природный минерал хрома – хромистый железняк FeCr2O4.
Соединения хрома(III) устойчивы в водных растворах, как к окислению, так и к восстановлению. В кислой среде под действием сильных восстановителей и в отсутствие воздуха они превращаются в соли хрома(II). Электродный потециал пары Cr(VI)/Cr(III) имеет наибольшее значение в кислой среде, поэтому окисление солей хрома(III) до хроматов и дихроматов проще осуществить в присутствии щелочи. При проведении реакции в щелочных водных растворах в качестве окислителей используют хлор, бром, гипохлорит натрия, пероксид водорода, оксид свинца(IV),:
2Cr(OH)3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O,
Cr(OH)3 + 3H2O2 + Ba(OH)2 = BaCrO4¯ + 4H2O,
в нейтральной или слабокислой средах – свежеосажденный оксид марганца(IV)
Cr2(SO4)3 + 3MnO2 + 2H2O = 2H2CrO4 + 3MnSO4,
в кислой среде – висмутат натрия, перманганат калия, бертолетову соль, персульфаты в присутствии катионов серебра
2Cr(NO3)3 + 3NaBiO3 + 4HNO3 = Na2Cr2O7 + 3Bi(NO3)3 + NaNO3 + 2H2O,
Cr2(SO4)3 + 3Na2S2O8 + 7H2O = 2Na2Cr2O7 + 7H2SO4 + Na2SO4,
а при сплавлении оксида хрома(III) – пероксиды щелочных металлов, нитраты, хлораты, кислород:
2Cr2O3 + 4Na2O2 + O2 = 4Na2CrO4,
Cr2O3 + KClO3 + 2K2CO3 = 2K2CrO4 + 2CO2 + KCl.
Процесс окисления происходит через стадии образования хромат(IV) и хромат(V) ионов.
При взаимодействии нитрата хрома(III) с белильной известью, взятой в недостатке, или при восстановлении хромата калия кипящим раствором тиосульфата натрия, серововодородом или этиловым спиртом в отсутствии минеральных кислот образуются коричневые осадки хроматов хрома(Ш) переменного состава, например, [Cr(OH)2]HCrO4. Строение их неизвестно. При добавлении избытка реагента (окислителя или восстановителя) содержащийся в них хром полностью переходит в одну из степеней окисления – +3 или +6. Так, дальнейшее пропускание сероводорода через щелочной раствор хромата калия приводит к изменению цвета осадка из бурого в грязно-зеленый, характерный для гидроксида хрома(III). Имеются сведения о том, что из водного ратсвора, полученного взаимодействием дихромата калия с пероксидом водорода после экстракции пероксида хрома в эфирный слой, может быть выделен коричневый осадок Cr5O12, представляющий собой хромат хрома(III). Строение этого вещества рассмотрено вместе с другими окисдами хрома.
Соединения хрома(III) химически инертны, то есть реакции замещения в их растворах протекают с низкой скоростью. Инертные комплексы не удается синтезировать по реакциям обмена в водных растворах. Например, даже при сильном избытке концентрированного раствора аммика, прилитого к свеже осажденному гидроксиду хрома(III), образуется лишь незначительное количество гексааммиаката. Для получения инертных комплексов либо используют очень большой избыток лиганда, что, например, достигается проведением реакции аминирования непосредственно в жидком аммиаке:
NaNH2
CrCl3 + 6NH3(жидк.) ¾¾® [Cr(NH3)6]Cl3,
либо проводят окислительно-восстановительную реакцию, скорость которой практически не зависит от скорости обмена лигандов, а определяется механизмом электронного переноса. Так, например, для получения гексаммиката хрома(III) сначала получают ион [Cr(NH3)6]2+, который, будучи лабильным, легко образуется при действии избытка аммиака на раствор хлорида хрома(II), а затем оставляют его в аммиачном буфере, который создают, добавляя твердый хлорид аммония. Постепенно ион гексамминхрома(II) восстанавливает водород воды или иона аммония, превращаясь в аммиакат хрома(III):
2[Cr(NH3)6]Cl2 + 2NH4Cl = 2[Cr(NH3)6]Cl3 + 2NH3 + H2.
Добавленный хлорид аммония служит также и источником хлорид-ионов, необходимых для формирования осадка трихлорида.
Комплекс [Cr(NH3)6]Cl3 называют лютеохромхлоридом из-за его желтой окраски (лат. lutus - желтый). Изомерный ему карминово-красный хлорид хлоропентамминхрома(III) [Cr(NH3)5Cl]Cl2 («пурпуреохромхлорид») образуется при взаимодействии хлорного хрома с жидким аммиаком в отсутствии катализатора – амида натрия, а также при кипячении родохромхлорида [(NH3)5Cr(OH)Cr(NH3)5]Cl5 с соляной кислотой (Рис. 5.14. Схема превращений между различными аммиакатами хрома(III)):
[(NH3)5Cr(OH)Cr(NH3)5]Cl5 + HCl = 2[Cr(NH3)5Cl]Cl2 + H2O.
Розовый осадок родохромхлорида (греч. rodoz - роза) получают окислением аммиаката хрома(II) кислородом воздуха
4[Cr(NH3)6]Cl2 + O2 + 4NH4Cl = 2[(NH3)5Cr(OH)Cr(NH3)5]Cl5¯ + 8NH3 + H2O.
В присутствии щелочи мостиковая гидроксо-группа депротонируется, это сопровождается изменением окраски на ярко-синюю вследствие образования «основной родо-соли» [(NH3)5Cr–O–Cr(NH3)5]Cl4. магнитный момент этого вещества (1,3 М. Б.) необычайно низок для соединения, содержащего шесть неспаренных электронов, что свидетельствует ою антиферромагнитном взаимодействии двух атомов хрома через р-орбитали атома кислорода посредством dp-pp-dp связывания. Известны и более сложные гидроксоаммиакаты хрома(III), например, родозохромхлорид [Cr4(OH)6(NH3)12]Cl6, в котором атомы хрома соединены друг с другом в цикл мостиковыми гидроксильными группами (H. U. Güdel, U. Hauser, A. Furrer, Inorg. Chem., 1979, 18, 2830).
Гекса- и пентамминные комплексы хрома(III) очень устойчивы к действию кислот. Так, при кипячении лютеохромхлорида с концентрированной азотной кислотой внутренняя координационная сфера не претерпевает никаких изменений, образуется лютеохромнитрат [Cr(NH3)6](NO3)3. Такая высокая устойчивость аммиакатов имеет кинетическую природу – она связана с тем, что атом азота, координирующий металл, не имеет свободных электронных пар и не способен образовывать устойчивые интермедиаты. В гексааквакомплексе хрома(III) каждая молекула воды содержит по одной паре электронов, не участвующих в образовании связей, что и обусловливает более высокую реакционную способность этой частицы.
При термическом разложении хлорида гексаамминхрома(III) образуется порошок mer-[Cr(NH3)3Cl3]. Граневый изомер fac-[Cr(NH3)3Cl3] может быть выделен при насыщении водного раствора аммиаката хрома(II) хлороводородом или при дейстивии на пероксохромат аммония (NH4)3CrO4 концентрированной соляной кислотой. Цис- и транс- изомеры хлорида тетраамминдихлорохрома [Cr(NH3)4Cl2]Cl получают косвенным путем, в основном, по реакциям обмена (W. G. Jackson, P. D. Vowles, W. W. Fee, Inorg. Chim. Acta, 1976, 19, 221).
В отличие от хрома, соединения молибдена(III) гораздо менее устойчивы, а вольфрама(III) практически неизвестны. Так, молибден в противоположность хрому не образует простых солей, а акваионы [Mo(H2O)6]3+ известны лишь в растворах, полученных при кислотном гидролизе комплексных соединений. Они имеют бледно-желтую окраску. Простейшим способом приготовления такого раствора является растворение гексахлоромолибдата(III) калия K3[MoCl6] или аквапентахлоромолибдата(III) аммония (NH4)2[MoCl5(H2O)] в воде, подкисленной хлорной или трифторметансульфокислотой (их анионы почти не проявляют донорных свойств) с последующим отделением хлорид-ионов при помощи анионита. При помощи сульфата цезия из такого раствора удалось выделить светло-желтые кристаллы цезий-молибденовых квасцов CsMo(SO4)2×12H2O. Содержащиеся в них ионы [Mo(H2O)6]3+ имеют три неспаренных электрона (m = 3.69 МБ) и, подобно ионам [Cr(H2O)6]3+, представляют собой правильный октаэдр с расстоянием Мо-О 0,209 нм (J. K. Beattie, S.P. Best, B. W. Skelton and A. H. White, J. Chem. Soc., Dalton Trans., 1981, 2105). На воздухе кристаллы квасцов буреют из-за окисления молибдена.
Концентрированные (примерно 0,5М) растворы [Mo(H2O)6]3+ удалось получить растворением формиатного комплекса Na3[Mo(HCOO)6], полученного взаимодействием аквапентахлоромолибдата(III) аммония с формиатом натрия в растворе муравьиной кислоты (M. Brorson and C. E. Schaffer, Acta Chem. Scand., Ser. A , 1986, 40, 358.). Подобно другим трехзарядным катионам, ионы гексааквамолибдена претерпевают гидролиз. В литературе имеются сведения о существовании димеров с мостиковыми ОН-группами или атомом кислорода и тройной связью металл-металл: [Mo2(OH)2(H2O)8]4+, [Mo2O(H2O)10]4+. Хотя процесс гидролиза сопровождается изменением окраски с бледно-желтой на зеленую, на него накладываются окислительно-восстановительные реакции, что затрудняет изучение. Аква-ионы молибдена(III) являются сильными восстановителями.
Исходными веществами для синтеза большинства координационных соединений молибдена(III) служат хлоридные комплексы, образующиеся при электролитическом восстановлении молибдатов. Если реакцию вести в среде концентрированной соляной кислоты, то образуется комплекс [MoCl6]3-, легко кристаллизующийся в форме розовой калийной соли K3MoCl6. Это вещество устойчиво при хранении в сухой атмосфере, но на влажном воздухе подвергается гидролизу и окислению. Введением бидентатных азотдонорных лигандов – орто-фенантролина (phen) и a,a¢-дипиридина (dipy) получают комплексы [Mo(phen)3]Cl3 и [Mo(dipy)3]Cl3 более устойчивые к окислению, чем анион [MoCl6]3-. Стабилизирующее действие лигандов на центральный атом объясняется их способностью акцептировать электроны молибдена.
Смешение горячих растворов K3[MoCl6] и роданида калия после охлаждения приводит к выделению оранжево-красных кристаллов роданидного комплекса K3[Mo(NCS)6]×4H2O, а при взаимодействии с цианидом калия образуется цианидный комплекс K4[Mo(CN)7]×2H2O черного цвета. Низкий магнитный момент этого соединения (1,75 МБ) связан со спариванием двух из трех d-электронов, находящихся на t2g-орбиталях.
Действием ацетилацетона на [MoCl5]3- получен легко сублимирующийся триацетилацетонат Mo(accac)3, который, в отличие от Cr(acac)3, легко окисляется на воздухе до соединений Mo(V). Среди комплексных соединений молибдена есть и диядерные кластеры, напоминающие ацетат хрома(II), но содержащие тройную связь молибден-молибден. Например, в красном гидрофосфатном комплексе Cs2[Mo2(HPO4)4(H2O)2] фосфатные группы выполняют роль мостиковых лигандов, Мо-Мо 0,2231 нм (A. Bino, F.A. Cotton, Angew. Chem., Int. Ed. Engl., 1979, 18, 462). Благодаря тройной связи металл-металл, это соединение устойчиво на воздухе. Кластерные ионы известны и среди сульфатных комплексов, образующихся из молибденовых квасцов при их дегидратации. В соединении K2[Mo2(SO4)4]×2,5H2O атомы молибдена, как и в фосфате, связаны попарно (Мо-Мо 0,211 нм). При хранении на воздухе цвет вещества становится синим за счет окисления одного атома молибдена: K3[Mo2(SO4)4]×3H2O (Мо-Мо 0,217 нм)
Соединения (+4)
Хром, молибден и вольфрам в степени окисления +4 имеют электронную конфигурацию d2. Все известные соединения хрома в этой степени окисления являются высокоспиновыми, а многие соединения молибдена и вольфрама – низкоспиновыми, диамагнитными, содержащими связь металл-металл.
Соединения хрома(IV) являются интермедиатами при восстановлении хроматов или окислении солей хрома(III). Как правило, они обладают низкой устойчивостью и не имеют практического значения.
Ионы [(H2O)5Cr=O]2+, образующиеся при окислении разбавленных растворов перхлората хрома(II) кислородом воздуха, имеют период полураспада около 30 с. Они проявляют сильные окислительные свойства не только по отношению к спиртам, фенолам, альдегидам, но и более слабым окислителям – простым эфирам, солям карбоновых кислот (S. L. Scott, A. Bakac, J. Y. Espenson, J. Amer. Chem. Soc., 1992, 114, 4205; A. Al-Ajlouni, A. Bakac, J. H. Espenson, Inorg. Chem., 1993, 32, 5792; A. Al-Ajlouni, A. Bakac, J. H. Espenson, 1994, 33, 1011). В твердом виде соли акваионов хрома(IV) не получены. При спекании хромитов(III) с оксидами щелочных металлов или смеси хромата(VI) и оксида хрома(III) со щелочью образуются изумрудно-зеленые порошки хроматов(IV):
1000 ºC
NaCrO2 + 2Na2O = Na4CrO4 + Na,
900 ºC
BaCrO4 + Cr2O3 + 5Ba(OH)2 = 3Ba2CrO4 + 5H2O.
Они растворяются в воде, образуя желто-коричневые растворы, подверженные необратимому гидролизу вследствие диспропорционирования на ионы Cr3+ и CrO42–. В структуре этих соединений содержится тетраэдрический ион CrO44– (R. Hoppe, W. Scheld, Z. Anorg. Alleg. Chem., 1987, 546, 137). Такую же геометрию имеет координационная сфера хрома и в алкоголятах Cr(OR)4, стабилизированных p-взаимодействием металл-лиганд, а также и в тетраалкилхроме CrR4. Примером соединений хрома(IV), устойчивых в водных растворах, являются пероксоамины [Cr(O2)2(NR3)x] (x = 2 – 3) (E. S. Gould, Coord. Chem. Rev., 1994, v. 135/136, p. 651). Простейшее из них охарактеризовано в разделе, посвященном пероксосоединениям.
Окисление порфириновых комлпексов хрома(II) на воздухе приводит к образованию порфиринов, содержащих двойную связь Cr=O.
Восстановление молибдатов водородом в момент выделения и другими сильными восстановителями либо сопропорционирование молибдатов(VI) и гексахлормолибдатов(III) в кислой среде приводит к образованию красных растворов, содержащих молибден(IV). В настоящее время установлено, что в них преобладает тример [Mo3O4(H2O)9]4+ (Рис. 5.15. строение (а) [Mo3O4(H2O)9]4+, (б) [Mo3O4(C2O4)3(H2O)3]2– ) , в котором атомы молибдена находятся в углах треугольника и связаны друг с другом оксо-мостиками (D.T. Richens, L. Helm, P.-A. Pittet, A. E. Merbach, F. Nicolo, G. Chapius, Inorg. Chem., 1989, 28, 1394). Многие анионы способны замещать молекулы воды, но строение молибден-кислородного цикла сохраняется без изменений:
[Mo3O4(H2O)9]4+ + 3C2O42– = [Mo3O4(C2O4)3(H2O)3]2– + 6H2O.
Примером моноядерного анионного комплекса молибдена(IV) служит октацианомолибдат(IV) калия, выделяющийся в форме золотисто-желтых пластинчатых кристаллов при восстановлении молибденового ангидрида или молибдата натрия боргидридом натрия или гидразином в среде концентрированной соляной кислоты:
4Na2MoO4 + 32KCN + NaBH4 + 25HCl = 4K4[Mo(CN)8] + H3BO3 + 13H2O + 16KCl + 9NaCl.
Атом молибдена расположен в центре додекаэдра, образованного восемью цианидными группами. Два валентных электрона молибдена спарены, что обусловливает диамагнетизм вещества.
При добавлении щелочи к растворам солей молибдена(IV) выпадает коричневый осадок гидроксида MoO2×xH2O (x примерно равен 2) переменного состава, растворимый как в кислотах, так и в избытке щелочей.
При восстановлении вольфраматов также могут быть получены растворы, содержащие ионы [W3O4(H2O)9]4+, сходные по строению с описанными выше аква-ионами молибдена(IV). Взаимодействием гексакарбонила вольфрама с уксусной кислотой и уксусным ангидридом получены различные триядерные оксоацетаты, в которых атомы вольфрама образуют треугольный кластер со связью W-W 0,281 нм, а две оксо-группы находятся в центре треугольника и образуют по три ковалентные связи (Рис. 5.15 (в, г) Строение иона [W3O2(CH3COO)6(H2O)3]2–). Ацетатные группы в этих соединениях служат мостиками, аналогично описанным ранее оксоацетатам двух- и трехвалентных металлов (A. Bino, F.A. Cotton, Angew. Chem. Int. Ed. Engl., 1979, 18, 462).
Соединения в степени окисления +5.
Данная степень окисления является неустойчивой для хрома – в настоящее время известно около трех десятков соединений, лишь половина из которых способна существовать в водном растворе. Обычно соединения хрома в данной степени окисления образуются при одноэлектронном восстановлении хроматов щавелевой и лимонной кислотами, изопропиловым спиртом и другими восстановителями, являясь интермедиатами, которые могут быть зафиксированы методом электронного парамагнитного резонанса. Введение в раствор a-гидроксикарбоновых кислот позволяет стабилизировать хром в степени окисления +5, благодаря образованию устойчивых хелатов

Их используют для изучения механизмов реакций восстановления хроматов в водных растворах. Например, с их помощью было доказано, что реакция хромата(VI) с иодид-ионами протекает как последовательность трех одноэлектронных переносов: Cr(VI) ® Cr(V) ® Cr(IV) ® Cr(III).
Хроматы(V), получаемые высокотемпературным сплавлением хроматов(VI) с щелочами в инертной атмосфере
800 ºC
4BaCrO4 + 2Ba(OH)2 = 2Ba3(CrO4)2 + O2 + 2H2O.
представляют собой черные или темно-зеленые порошки, разлагающиеся водой на хроматы(VI) и соединения хрома(III). В структуре этих соединений присутствуют ионы CrO43–, имеющие форму тетраэдра.
Удобный источник аквакомплексов молибдена(V) представляет собой пентахлорид MoCl5. В подкисленных водных растворах молибден(V) присутствует, главным образом, в форме диядерных катионов
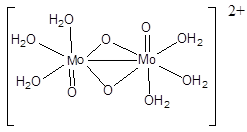
Диамагнетизм этих ионов, окрашивающих раствор в желто-оранжевый цвет, свидетельствует о взаимодействии двух неспаренных d-электронов атомов молибдена с образованием одинарной связи Мо-Мо. Часто используют сокращенную форму записи димеров Mo2O42+. Другим способом получения солей оксомолибдена(V) является восстановление молибдатов(VI) или окисление ацетата молибдена (II). Димеры Mo2O42+ сохраняются и во многих комплексных соединениях молибдена(V), например, [Mo2O4(C2O4)2(H2O)2]2–, [Mo2O4(edta)]2–. При подщелачивании растворов выделяется оранжево-коричневый осадок гидроксида MоO(OH)3. Он устойчив в водном растворе при рН 6 и проявляет кислотные свойства (Ка = 0,13). В концентрированных растворах щелочей он диспропорционирует на MoO42– и оксоанионы молибдена(IV), придающие раствору сине-зеленую окраску. Сильные восстановители (цинк, ионы хрома(II), водород в момент выделения и др.) переводят их в соединения молибдена(IV) и (III) через стадию образования ионов, содержащих атомы молибдена в различных степенях окисления.
Восстановление вольфраматов цинком в среде концентрированной соляной кислоты приводит к появлению синей окраски, обусловленной ионами [WOCl5]2–. При их гидролизе образуются ионы димеры W2O42+, по-видимому, аналогичные димерам Mo2O42+. Химия соединений вольфрама(V) изучена гораздо меньше.
Соединения в степени окисления +6.
Высшая степень окисления является наиболее устойчивой для молибдена и вольфрама. Соединения хрома (VI) также широко известны. Они являются сильными окислителями и активно используются в технике и лабораторной практике.
Триоксид хрома CrO3 является ангидридом хромовой кислоты, которая образуется при растворении его в в воде.
CrO3 + H2O = H2CrO4,
Это кислота средней силы, известная лишь в водных растворах, в которых наряду с равновесиями диссоциации
H2CrO4  H+ + HCrO4– , pK = 5,9
H+ + HCrO4– , pK = 5,9
HCrO4–  H+ + CrO42– , pK = –0,61
H+ + CrO42– , pK = –0,61
протекают также процессы поликонденсации хромат-ионов:
2HCrO4–  Cr2O72– + H2O, pK = –2,2
Cr2O72– + H2O, pK = –2,2
CrO42– + 2H+  Cr2O72– + H2O, pK = –13,7.
Cr2O72– + H2O, pK = –13,7.
Строго говоря, водный раствор хромового ангидрида представляет собой смесь хромовой и двухромовой кислот, которые находятся в равновесии друг с другом. Хотя ни одна из этих кислот не выделена в свободном виде, их соли – хроматы и дихроматы – хорошо изучены. Как следует из приведенного выше уравнения, взаимные переходы между ними осуществляются при изменении кислотности среды. В кислых растворах устойчивы дихроматы, а в щелочной – хроматы. О взаимных превращениях этих солей легко судить по изменению окраски: хроматы имеют желтый цвет, а дихроматы – оранжевый. Например, при подкислении желтого раствора K2CrO4 образуется оранжево-красный бихромат K2Cr2O7
2K2Cr2O4 + 2H2SO4 Û K2Cr2O7 + 2KHSO4 + H2O.
Окраска солей хромовых кислот является очень насыщенной, так что даже небольшое количество соли придает раствору желтый или оранжево-красный цвет. Окраска этих растворов обусловлена полосой переноса заряда, то есть электронными переходами со связывающих молекулярных орбиталей, локализованных преимущественно на атомах кислорода, на разрыхляющие молекулярные орбитали, локализованные на атоме хрома.
Процесс полимерзации хромат-иона протекает через стадию протонирования
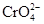 + H+
+ H+ 
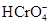
Гидрохромат-ионы, имеющие искаженную тетраэдрическую геометрию, объединяются в пары общими вершинами с образованием связей Cr – O – Cr и отщеплением молекул Н2О
2 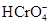

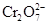 + H2O.
+ H2O.
Равновесие
2 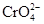 + 2Н+
+ 2Н+ 
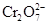 + H2O
+ H2O
смещается влево также в присутствии ионов Ва2+, Ag+, Pb2+, которые образуют мало растворимые хроматы, например,
2K2Cr2O7 + 2BaCl2 + H2O = 2BaCrO4¯ + 4KCl + H2Cr2O7.
За счет образования кислоты H2Cr2O7 полного осаждения хрома невозможно добиться прибавлением даже избытка соли бария: раствор сохраняет желто-оранжевый цвет. Чтобы количественно осадить весь хром, содержащийся в растворе, вводят ацетат натрия. Двухромовая кислота по силе превосходит уксусную, и поэтому вытесняет ее из солей:
K2Cr2O7 + 2BaCl2 + H2O + 2CH3COONa = 2BaCrO4¯ + 2KCl + + 2NaCl + 2CH3COOH.
В воде растворимы лишь хроматы и дихроматы щелочных металлов и аммония, а также магния, кальция и стронция. Растворимость хроматов щелочных и щелочно-земельных элементов убывает вниз по группе. Так, при 30 °C в 100 г воды растворяются 100 г Li2CrO4, 88,7 г Na2CrO4, 63,4 г K2CrO4, 44,1 г Rb2CrO4. Дихроматы щелочных металлов имеют более низкую растворимость, чем хроматы. Хроматы лития и натрия кристаллизуются из растворов в виде гидратов (Рис. 5.16. а) Кривые растворимости хроматов и дихроматов натрия, калия и аммония; б) фазовая диаграмма системы Na2Cr2O7-H2O). Интересно, что декагидрат Na2CrO4×10H2O изоморфен глауберовой соли Na2SO4×10H2O и образует с ней смешанные кристаллы в любых соотношениях. Хромат бария нерастворим в воде, а хроматы кальция и стронция могут быть выделены из растворов в виде гидратов MCrO4×2H2O (M = Ca, Sr) высаливанием спиртом. Растворимость CaCrO4 при нагревании уменьшается, подобно растворимости многих других соединений кальция (CaSO4, Ca(OH)2).
Растворы хроматов и дихроматов имеют реакцию среды, близкую к нейтральной, так как они образованы кислотами средней силы. Кислые соли хромовой кислоты неизвестны, при концентрировании растворов гидрохромат-ионы отщепляют воду и переходят в дихроматы. В литературе также имеются сведения об оксосолях хромовой кислоты, иногда называемых ортохроматами. Натриевая соль Na4CrO5×13H2O представляет собой светло-желтые ромбические кристаллы, хорошо растворимые в воде. Они устойчивы в водном растворе и могут быть перекристаллизованы, однако в присутствии кислот и щелочей разлагаются до хроматов или дихроматов. Известна также аналогичная кальциевая соль, в воде нерастворимая. Помимо этого, кальций образует с хромат-ионами основную соль Ca5(CrO4)3OH, изоморфную минералу апатиту.
Из растворов хромата натрия, а также из разбавленных растворов дихромата натрия нитрат серебра осаждает буро-красный хромат серебра Ag2CrO4 (ПР = 1,2×10–12), а из концентрированных растворов дихромата – темно-красный дихромат Ag2Cr2O7 (ПР = 1,0×10–10). Дихромат свинца вообще не удается получить в твердом виде по причине низкой растворимости хромата PbCrO4 (ПР = 1,8×10–14), используемого в качестве желтого пигмента. При растворении хромата свинца в азотной кислоте образуется оранжевый раствор, содержащий дихромат свинца. В индивидуальном виде это соединение не выделено. При попытке осаждения хромата свинца из щелочных растворов образуется огненно-красный осадок основной соли Pb2(OH)2CrO4. При нагревании он переходит в оксосоль Pb2CrO5 (минерал феникохроит), также имеющую красную окраску (Рис. 5.17. Фазовая диаграмма PbCrO4 – PbO (с упрощениями)). Это соединение используют в качестве пигментов под названием свинцовый красный. Основную соль легко получить также добавлением к осадку хромата свинца небольшого количества щелочи. Желтый осадок хромата бария BaCrO4 также растворим в кислотах с образованием оранжевых растворов, но, в отличие от свинцовой соли, коричневый дихромат бария BaCr2O7×2H2O выделен в твердом виде при кристаллизации из сильнокислых растворов, полученных растворением в воде хлорида бария и избытка хромового ангидрида (Blum D., J. Appl. Crystallogr., 1980, 13, 96). Его дегидратацией при 120 °С получают безводную соль. При действии на раствор хромата натрия нитратом ртути(I) образуется аморфный бурый осадок хромата Hg2CrO4, который при кипячении переходит к кристаллический хромат ртути(I) ярко-красного цвета. Интересно, что надежных сведений о получении хроматов и дихроматов железа(II) и (III) в литературе нет, при смешении растворов солей железа с хроматами и дихроматами осадка не образуется. Данные о выделении коричневого дихромата железа(III) Fe2(Cr2O7)3 при нейтрализации гидроксида железа(III) хромовым ангидридом, приводимые в справочнике Меллора, нуждаются в проверке. Известны гидроксохроматы KFe3(OH)6(CrO4)2 и NaAl3(OH)6(CrO4)2 (Y. Cudennec, A. Riou, A. Bonnin, P. Caillet, Rev. Chim. Miner., 1980, 17, 158). Для меди(II) известен как хромат CuCrO4, так и дихромат CuCr2O7×2H2O (Blum D., Guitel J.C., Acta Cryst. B, 1980, 36, 667).
Дихромат-ионы, образующиеся при действии кислоты на хроматы, при более сильном подкислении превращаются в трихроматы Cr3O102- и тетрахроматы Cr4O132-, продукты углубляющейся поликонденсации хромат-ионов. С катионами щелочных металлов три- и тетрахромат ионы образуют соли, напоминающие дихроматы и окрашенные в темно-красный цвет. Подобно дихроматам, они состоят из тетраэдров CrO4, соединенных общими вершинами в цепи. При дальнейшем подкислении процесс поликонденсации протекает еще глубже, конечным его продуктом является темно-красный осадок гидратированного хромового ангидрида, фактически представляющий собой полихромовую кислоту – длинные цепи из тетраэдров CrO4, на концах которых находятся гидроксильные группы. При нагревании до 100 °C происходит его дегидратация, приводящая к оксиду хрома(VI) (Рис. 5. 18. Процессы поликонденсации хромат-ионов).
Термическая устойчивость солей хромовых кислот зависит как от природы металла, так и от строения аниона. При усложнении аниона, то есть в ряду хромат-дихромат-трихромат-тетрахромат температура разложения солей существенно убывает. Так, хромат калия плавится без разложения при 968 ºС, дихромат (т. пл. 398 ºС) разлагается при 500 ºС, а трихромат и тетрахромат плавятся с разложением при 243 и 210 °C, соответственно:
550 °C
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 + 3O2,
220 °C
2K2Cr4O13 = 2K2Cr2O7 + 4 KCr(CrO4)2 + 3O2.
Термическая устойчивость солей возрастает с увеличением размера катиона щелочного металла, что является следствием роста энергии кристаллической решетки (об этом свидетельствует и понижение растворимости в этом ряду).
Окислительная способность соединений хрома в высшей степени окисления существенно выше, чем у молибдена и вольфрама. Хроматы являются очень сильными окислеителями, хотя и уступают перманганатам. Наибольшая окислительная активность хроматов наблюдается в кислой среде, где они присутствуют в виде дихромат-ионов (E0(Cr2O72– /Cr3+ = 1.33 B, pH = 0). В этих условиях они могут быть восстановлены до солей хрома(III) сернистым газом, сероводородом, сульфидами, тиосульфатами, глюкозой, солями титана(III) и железа(II):
K2Cr2O7 + 3SO2 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O,
K2Cr2O7 + 3H2S + 4H2SO4 = K2SO4 + Cr2(SО4)3 + 3S¯ + 7H2O,
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2О.
В нейтральной и слабо-щелочной средах хромат-ионы восстанавливаются до гидроксида хрома (III)
K2CrO4 + 3(NH4)2S + 8H2O = 2Cr(OH)3¯ + 3S¯ + 4KOH + 6NH3×H2О,
а в сильно щелочной – до гидроксохроматов(III) [Cr(OH)6]3-
2K2CrO4 + 3(NH4)2S + 2KOH = 2K3[Cr(OH)6] = 3S¯ + 6NH3.
В щелочной среде окислительная способность хроматов значительно ниже (E0(CrO42– /Cr(OH)3 = –0.13 B, pH = 14), поэтому для их перевода в соединения хрома(III) используют более сильные восстановители – гидразин, борогидриды, гипосульфиты и гипофосфиты.
С высокой окислительной способностью хроматов и дихроматов связана и канцерогенность этих соединений. Хромат-ион, по строению напоминающий сульфат, легко переносится через клеточную мембрану. Оказываясь внутри клетки, он участвует во многих окислительно-восстановительных процессах, включая взаимодействие с серосодержащими аминокислотами и пептидами, некоторыми редуктазами, а также с участниками процесса окислительного фосфорилирования. Помимо этого, хромат-ионы способны окислять содержащиеся в цитоплазме глюкозу, аскорбат-ионы и молекулы пероксида водорода. Образующиеся в результате этого свободные радикалы приводят к об
Дата добавления: 2016-01-03; просмотров: 5502;
