Химические свойства простых веществ
При умеренных температурах все три металла устойчивы на воздухе. На воздухе хромированные изделия не тускнеют, так как тонкая и прозрачная пленка оксида надежно защищает его от окисления. В шестой группе сохраняется общая закономерность, согласно которой 3d-металлы имеют гораздо более высокую реакционную способность по сравнению с 4d- и 5d-металлами. Так, хром, подобно титану, без доступа воздуха легко растворяется в соляной кислоте с образованием сине-голубых растворов солей хрома(II):
Cr + 2HCl = CrCl2 + H2
В лаборатории реакцию обычно проводят с использованием клапана Бунзена, представляющего собой резиновую пробку с трубкой, на которую надет шланг, имеющий прорезь и закрытый с противоположного конца (Рис. 5.2. Устройство клапана Бунзена). Во избежание контакта с воздухом на поверхность раствора можно также налить слой легкого органического растворителя – бензина или эфира.
На воздухе голубое окрашивание растворов сменяется на зеленое, что обусловлено окислением ионов хрома(II) до хрома(III):
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2O.
С кислотами-окислителями – концентрированной серной и азотной – при комнатной температуре хром не взаимодействует. Не растворяется он и в царской водке. Интересно, что очень чистый хром не реагирует даже с разбавленной серной кислотой, хотя причина этого в точности не установлена. При выдерживании в концентрированной азотной кислоте хром пассивируется, то есть утрачивает способность взаимодействовать с разбавленными кислотами. В основе явления пассивации лежит модификация поверхности металла, которая покрывается тонким, но прочным слоем оксида, надежно предохраняющим металл от дальнейшего окисления.
Несмотря на то, что молибден и вольфрам в ряду напряжений стоят левее водорода, они, подобно другим тяжелым переходным металлам, не взаимодействуют с кислотами-неокислителями. Однако смесь концентрированных кислот HNO3 + HF переводит их в раствор, например,
W + 8HF + 2HNO3 = H2WF8 + 2NO + 4H2O.
В отличие от вольфрама, молибден хорошо растворим также и в горячих концентрированных растворах азотной или серной кислот.
Все три металла устойчивы в щелочных растворах, но в присутствии окислителей (KNO3, KClO3) они растворяются в расплавах щелочей:
Э + 3KNO3 + 2KOH 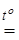 К2ЭO4 + 3KNO2 + H2O.
К2ЭO4 + 3KNO2 + H2O.
При температуре красного каления мелкие порошки металлов шестой группы взаимодействуют с водяным паром, вытесняя водород и образуя оксиды
900 ºС
2Cr + 3H2O = Cr2O3 + 3H2.
При нагревании металлы шестой группы вступают в реакции с неметаллами, при этом сохраняется общая тенденция: в большинстве случаев молибден и вольфрам окисляются до степени окисления +6, а хром до +3. Так, порошки металлов при нагревании в кислороде примерно до 600 ºС воспламеняются, сгорая до оксидов Cr2O3, MoO3 и WO3. В атмосфере фтора хром превращается в трифторид CrF3, а молибден и вольфрам – в высшие фториды MoF6, WF6, при хлорировании образуются CrCl3, MoCl5 и WCl6, соответственно. Серой хром окисляется до смеси сульфидов, в которой при избытке серы преобладает Cr2S3, а молибден и вольфрам – до дисульфидов MS2. С азотом, углеродом все металлы шестой группы образуют высокотвердые и жаропрочные нитриды (Э2N, Э5N2, ЭN и т.д.) и карбиды (Э2С, ЭС и т.д.). Гидриды хрома, молибдена и вольфрама неустойчивы и образуются только при высоких давлениях водорода (>100 кПа). Для хрома известен лишь гидрид CrН, что согласуется с общей закономерностью уменьшения устойчивости гидридов d-металлов при движении в периодах слева направо и в группах сверху вниз.
Свойства оксидов
Для элементов шестой группы известны бинарные кислородные соединения со степенями окисления +6 (CrO3, MoO3, WO3), +4 (CrO2, MoO2, WO2), +3 (только Cr2O3), а также оксиды смешанными степенями окисления, образующими гомологичные ряды.
Низший оксид МО получен только для хрома. Он представляет собой черный тугоплавкий порошок, нерастворимый в воде. Оксид хрома(II) проявляет основные свойства и медленно переходит в раствор под действием кислот:
CrO + 2HCl = CrCl2 + H2O.
Подобно другим соединениям хрома(II), он является сильным восстановителем. При растирании на воздухе или при нагревании он воспламеняется, сгорая до оксида хрома(III), а при температуре белого каления даже способен отнимать кислород от углекислого газа:
1000 ºС
2CrO + CO2 = Cr2O3 + CO.
Нагревание в инертной атмосфере или в вакууме приводит к диспропорционированию:
3CrO  Cr2O3 + Cr.
Cr2O3 + Cr.
При 1000 ºС водород восстанавливает оксид хрома(II) до металла.
Оксид хрома (III) Cr2O3 или хромовая охра представляет собой твердый грязно-зеленый тугоплавкий (Тпл = 2275 оС) порошок со структурой корунда (a-Al2O3, рис. из т. II). При комнатной температуре он обладает полупроводниковыми свойствами, а ниже 35 оС – является антиферромагнетиком.
Интересно, что цвет этого вещества зависит от размера частиц: крупные кристаллы, полученные из расплава, - практически черные, а мельчайший порошок, образующийся при конденсации из газовой фазы, имеет красный цвет. При нагревании оксид хрома (III) становится коричневым, но при охлаждении прежняя окраска восстанавливается. С корундом оксид хрома(III) образует твердые растворы (Рис. 5.3. Диаграмма состояния Cr2O3 – Al2O3), в которых в пустотах анионной подрешетки находятся атомы хрома и алюминия. Твердые растворы на основе корунда, содержащие до 4% оксида хрома(III), окрашены в красный цвет и встречаются в природе в виде минерала рубина, издревле известного как драгоценный камень. Интересно, что рубиново-красный цвет твердого раствора сохраняется лишь при низком процентном содержании оксида хрома – до тех пор, пока октаэдры CrO6 не связаны друг с другом. Твердые растворы с более высокой долей оксида хрома имеют зеленый цвет.
Мелкий рентгеноаморфный порошок оксида хрома(III) образуется при сжигании мелко раздробленного металла, дегидратации гидроксида, нагревании хромового ангидрида или хлористого хромила, сплавлении дихроматов с серой или углем
K2Cr2O7 + S 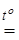 Cr2O3 + K2SO4
Cr2O3 + K2SO4
Na2Cr2O7 + 2C 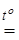 Cr2O3 + Na2CO3 + CO.
Cr2O3 + Na2CO3 + CO.
Удобным способом получения этого вещества является термическое разложение дихромата аммония
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Для протекания реакции требуется нагревание до 200 ºС, после чего процесс протекает самопроизвольно с выделением большого количества теплоты. Выделяющиеся газы разбрасывают мелкий порошок оксида хрома(III), создавая форму, напоминающую кратер вулкана, в центре которого видно пламя. Благодаря этому в практике демонстрационного эксперимента этот опыт получил название «химический вулкан». (Сноска: описания других «химических вулканов» приведены в книге: Б. Д. Степин, Л. Ю. Аликберова, Занимательные задания и эффектные опыты по химии, М., Дрофа. 2002).
Оксид хрома (III) – это самое устойчивое соединение хрома. Он является амфотерным, но благодаря высокой энергии кристаллической решетки не реагирует не только с водой, но и с растворами кислот и щелочей. Для перевода его в растворимое состояние без изменения степени окисления используют хлорирование в присутствии восстановителя (C + Cl2), сплавление c пиросульфатами
Cr2O3 + 3K2S2O7 = 3K2SO4 + Cr2(SO4)3,
карбонатами или гидроксидами щелочных металлов
Cr2O3 + Na2CO3 = 2NaCrO2 + CO2,
Cr2O3 + 2NaOH = 2NaCrO2 + H2O.
При температуре красного каления протекает реакция с парами четыреххлористого углерода:
Cr2O3 + 3CCl4 = 2CrCl3 + 3COCl2.
При сплавлении с окислителем (NaNO3, O2, Na2O2, KClO3) и карбонатами или гидроксидами щелочных металлов он превращается в хроматы
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2,
2Cr2O3 + 3O2 + 8NaOH = 4Na2CrO4 + 4H2O.
Для восстановления его до хрома наиболее эффективна алюмотермия, так как в реакциях с водородом и оксидом углерода(II) равновесие смещено влево даже при температурах выше 1000 оС (Сноска: при 1133 ºС равновесное давление водяного пара в реакции Cr2O3 + 3H2 = 2Cr + 3H2O составляет всего 0,815 мм рт. ст.).
С оксидами металлов оксид хрома(III) образует хромиты.
Мелкий порошок оксида хрома (III) применяют в качестве абразивного материала (пасты ГОИ), зеленого пигмента, катализатора в органическом синтезе. Он служит основной добавкой к корунду при выращивании из расплава кристаллов рубина, который используется в ювелирной и часовой промышленности, а также в качестве лазерного материала в оптоэлектронике.
Коричнево-черные диоксиды МО2 имеют структуру рутила (рис. 1.16). Они химически инертны по отношению к воде и щелочам, но кислоты-окислители переводят их в соединения высшей степени окисления. Оксид хрома(IV) обладает металлической проводимостью, ферромагнитными свойствами и применяется в производстве элементов памяти для компьютеров и бытовых радиоэлектронных приборов. Диоксиды образуются как промежуточные продукты при разложении в отсутствии кислорода или восстановлении соединений M(VI) в мягких условиях
250 ºC, N2
3(NH4)2Cr2O7 = 6CrO2 + 4N2 + 9H2O + 2NH3
450 ºC
MoO3 + H2 = MoO2 + H2O
600 оС
WO3 + H2 = WO2 + HO.
Оксид хрома(IV) получают нагреванием оксида хрома(III) в кислороде при 300 ºС и повышенном давлении.
Устойчивость диоксидов повышается в ряду CrO2 – MoO2 – WO2. Если оксид хрома(IV) разлагается выше 400 оС с образованием Cr2О3
2CrO2 = Cr2О3 + 1/2О2,
то МоО2 диспропорционирует выше 100 оС на МоО3 и Мо
3МоО2 = Мо + 2МоО3,
а WO2 плавится при 1270 оС без разложения.
Для хрома известно также несколько оксидов, содержащих атомы металла в различных степенях окисления, например, в +3 и +6. Такие соединения формально можно рассматривать как хроматы хрома(III). Так, оксид Cr5O12 или (Сr+3)2(Cr+6O4)3 состоит из тетраэдров [Cr+6O4] и октаэров [Cr+3O6], соединенных общими вершинами (Рис. 5.4. Структура хромата хрома(III)) (Wilhelmi K.A., Acta Chem. Scand., 1965, v. 19, p. 165). Недавно появилось сообщение о синтезе и кристаллической структуре еще более сложного оксида, представляющего собой хромат-тетрахромат хрома(III): (Сr+3)2(Cr+6O4)2(Cr4+6O13) (Norby P., Norlund Chistensen A., Fjellvag H., Nielsen M., J. Solid State Chem., 1991, v. 94, p. 281).Известны также и двойные хроматы хрома(III) и щелочных металлов NaCr(CrO4)2, KCr(CrO4)2 (Saavedra M.J., Parada C., Baran E.J., J. Phys. Chem. Solids, 1996, v. 57, p. 1929), образующиеся при нагревании смеси бихромата с хромовым ангидридом.
ДОПОЛНЕНИЕ. Гомологические ряды оксидов.
Между МО2 и МО3 существует большое число промежуточных фаз (Mo4O11, Mo17O47, W18O49, W20O58 и др.), образующих различные гомологические ряды, например, MnO3n-1, MnO3n-2. Они представляют собой синие или фиолетовые порошки, устойчивые на воздухе, и образуются при частичном восстановлении триоксидов МО3 со структурой ReO3, сопровождающимся образованием значительной концентрации кислородных вакансий  . При «кристаллографическом сдвиге» плоскости, содержащие эти вакансии, исчезают за счет их смещения относительно других плоскостей. При таком сдвиге образуются группы октаэдров, имеющих общие грани (Рис. 5.5. Схематическое представление структуры Мо8О23. Плоскости кристаллографического сдвига, изображенные черными линиями, разделяют фрагменты со структурным типом ReO3. По линиям этих плоскостей находятся октаэдры МоО6, соединенные гранями). Такие плоскости названы плоскостями кристаллографического сдвига. Они позволяют согласовать аниондефицитную стехиометрию без введения точечных дефектов и без изменения координационного числа катионов. Регулярно повторяющиеся плоскости кристаллографического сдвига приводят к гомологическим рядам промежуточных фаз. Появление в кристалле эквидистантных плоскостей указывает на кооперативный механизм кристаллографического сдвига. Формула фазы с кристаллографическим сдвигом зависит как от индекса плоскости, так и от толщины фрагмента исходной фазы между плоскостями кристаллографического сдвига. Если MOa – формула исходной граничной фазы, то формула гомологического ряда оксидов имеет вид MnOan-m, где n – толщина (число октаэдров) исходной структуры между плоскостями кристаллографического сдвига, а m – число исключенных кислородных вакансий. Например, WnO3n-1 и WnO3n-2 соответствуют двум гомологическим рядам оксидов, полученных из исходной структуры ReO3 на основе плоскостей кристаллографического сдвига с индексами (120) и (130), соответственно. В качестве представителя ряда WnO3n-1 можно привести оксид WO3-d (d = 0.07), а ряда WnO3n-2 –
. При «кристаллографическом сдвиге» плоскости, содержащие эти вакансии, исчезают за счет их смещения относительно других плоскостей. При таком сдвиге образуются группы октаэдров, имеющих общие грани (Рис. 5.5. Схематическое представление структуры Мо8О23. Плоскости кристаллографического сдвига, изображенные черными линиями, разделяют фрагменты со структурным типом ReO3. По линиям этих плоскостей находятся октаэдры МоО6, соединенные гранями). Такие плоскости названы плоскостями кристаллографического сдвига. Они позволяют согласовать аниондефицитную стехиометрию без введения точечных дефектов и без изменения координационного числа катионов. Регулярно повторяющиеся плоскости кристаллографического сдвига приводят к гомологическим рядам промежуточных фаз. Появление в кристалле эквидистантных плоскостей указывает на кооперативный механизм кристаллографического сдвига. Формула фазы с кристаллографическим сдвигом зависит как от индекса плоскости, так и от толщины фрагмента исходной фазы между плоскостями кристаллографического сдвига. Если MOa – формула исходной граничной фазы, то формула гомологического ряда оксидов имеет вид MnOan-m, где n – толщина (число октаэдров) исходной структуры между плоскостями кристаллографического сдвига, а m – число исключенных кислородных вакансий. Например, WnO3n-1 и WnO3n-2 соответствуют двум гомологическим рядам оксидов, полученных из исходной структуры ReO3 на основе плоскостей кристаллографического сдвига с индексами (120) и (130), соответственно. В качестве представителя ряда WnO3n-1 можно привести оксид WO3-d (d = 0.07), а ряда WnO3n-2 – 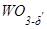 (0.07£ d’³0.13).
(0.07£ d’³0.13).
КОНЕЦ ДОПОЛНЕНИЯ
Высшие оксиды хрома, молибдена и вольфрама.
Оксид хрома(VI), или хромовый ангидрид, по свойствам значительно отличается от высших оксидов молибдена и вольфрама (табл. 5.4.).
Таблица 5.4. Свойства оксидов МО3
| -DfGo(298), кДж/моль | Структура | Температура плавления, оС | Температура кипения, оС | Плотность, г/см3 | |
| CrO3 темно-красный | Ромбическая | Разлагается | 2.70 | ||
| a-MoO3 белый | Ромбическая | 4.69 | |||
| a-WO3 желтый | Моноклинная | 1850-2000 | 7.28 |
Он представляет собой темно-красные призматические кристаллы, состоящие из тетраэдров CrO4, связанных вершинами в цепи. При 197 ºС они плавятся, превращаясь в летучую темную жидкость, пары которой окрашены в красный цвет. Термическая устойчивость хромового ангидрида, по-видимому, зависит от способа его получения и чистоты – разложение происходит в интервале 200 – 550 ºС и заканчивается образованием оксида хрома(III):
4CrO3 = 2Cr2O3 + 3O2.
Белые кристаллы высшего оксида молибдена MoО3 имеют слоистую структуру, в которой октаэдры МоО6, сильно искаженные из-за неравноценности связей Мо–О, соединяются и вершинами, и ребрами (Рис. 5.6. Строение MoO3). При нагревании они становятся желтыми, а при 795 ºС плавятся, превращаясь в подвижную жидкость. Оксид вольфрама(VI) WО3 представляет собой желтый кристаллический порошок. Его структура образована октаэдрами WО6, связанными между собой всеми вершинами. Такой структурный тип исторически получил название «структура типа ReO3» по первому исследованному веществу аналогичного строения. Известны несколько модификаций WО3, в которых атом вольфрама смещен из центра октаэдра, и возникающая деформация ведет к понижению симметрии.
Триоксиды молибдена и вольфрама, в отличие от хромового ангидрида, сублимируются конгруэнтно, т.е. состав пара совпадает с составом твердой фазы, причем оксид молибдена более летуч, чем оксид вольфрама – при 800 ºС давление пара над ним составляет 1,347 кПа. В паре эти вещества присутствуют в виде циклических тримеров M3O9, тетрамеров M4O12 и пентамеров M5O15, представляющих собой тетраэдры, соединенные вершинами. В растворах оксидов в донорных растворителях – пиридине, диметилсульфоксиде, – наряду с циклическими молекулами, присутствуют и линейные: об этом свидетельствует выделение аддукта Mo3O4×4dmso, состоящего из бесконечных цепей, соединенных оксо-мостиками (E.M. McCarron, R. L. Harlow, Chem. Commun., 1983, 90). Из растворов гидратированного оксида молибдена в метаноле получены кристаллы Mo2O5(CH3O)2.
В ряду CrO3 – MoO3 – WO3 возрастают энергии Гиббса образования (Df 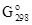 ), температуры плавления (Тпл) и кипения (Ткип) (табл. 5.4.), что связано с усилением ионной составляющей химической связи.
), температуры плавления (Тпл) и кипения (Ткип) (табл. 5.4.), что связано с усилением ионной составляющей химической связи.
Высшие оксиды хрома, молибдена и вольфрама имеют преимущественно кислотный характер, который наиболее ярко выражен в случае оксида хрома(VI). Это вещество прекрасно растворимо в воде (при 20 ºС 62,5 г CrO3 в 100 г раствора), а водный раствор проявляет кислотные свойства – он содержит хромовую H2CrO4 и двухромовую H2Cr2O7 кислоты. Вновь выделить хромовый ангидрид из раствора удается действием концентрированной серной кислоты и выдерживанием полученного осадка в вакууме для полного обезвоживания. Оксиды молибдена и вольфрама растворимы в воде значительно хуже. Кислотная природа этих оксидов проявляется при их растворении в щелочах
2KOH + MO3 = K2MO4 + H2O.
Хромовый ангидрид, в отличие от триоксидов молибдена и вольфрама, является сильным окислителем. Он поджигает этанол
4CrO3 + C2H5OH = 2Cr2O3 + 2CO2 + 3H2О,
окисляет уголь и монооксид углерода:
tº
2CrO3 + 3CO = Cr2O3 + 3CO2.
Раствор хромового ангидрида в концентрированной серной кислоте при кипячении выделяет кислород:
tº
4CrO3 + 6H2SO4конц = 2Cr2(SO4)3 + 6H2O + 3O2.
Темно-красные кристаллы хромового ангидрида образуются при действии концентрированной серной кислоты на насыщенный раствор дихромата калия
K2Cr2O7 + 2H2SO4 = 2CrO3¯ + 2KHSO4 + H2O.
Также он может быть получен при окислении оксида хрома(III) озоном или кислородом при повышенном давлении (12 атм), температуре 460 ºС и в присутствии катализаторов на основе оксидов серебра, цинка, кадмия и свинца.
Высшие оксиды молибдена и вольфрама получают сжиганием металлов на воздухе или в кислороде (желтый порошок WO3 образуется при сгорании вольфрамовой спирали электроламп при попадании воздуха внутрь лампы),
окислением дисульфидов
2MoS2 + 7O2 = 2MoO3 + 4SO2,
а также прокаливанием молибдатов и вольфраматов аммония
(NH4)6Mo7O24 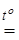 7MoO3 + 6NH3 + 3H2O.
7MoO3 + 6NH3 + 3H2O.
Эту реакцию проводят в токе кислорода, чтобы избежать частичного восстановления триоксидов выделяющимся аммиаком.
Дата добавления: 2016-01-03; просмотров: 2731;
