Гетерополисоединения
(Ссылка ко всему разделу: М. С. Поп, Гетерополи- и изополиоксометаллаты, Наука, Новосибирск. 1990; M. T. Pope, Progr. Inorg. Chem., 1991, 39, 181.; M.I. Khan, J. Zudieta, Progr. Inorg. Chem., 1995, 43, 1.).
Между октаэдрами, образующими изополианионы, имеются пустоты, в которых могут помещаться различные гетероатомы, например, бор, кремний, фосфор, германий, а также многие 3d-металлы – хром, марганец, железо, кобальт, никель, цинк. Такие частицы называют гетерополианионами, а вещества, в состав которых они входят – гетерополисоединениями. В гетерополианионах гетероатом расположен в тетраэдрической или октаэдрической полости, образованной атомами кислорода соседних октаэдров.
Обычным методом синтеза гетерополисоединений является взаимодействие молибдатов или вольфраматов с растворами, содержащими соединения гетероатомов – в случае неметаллов это тетраэдрические оксоанионы, а в случае металлов – гексааквакомплексы. Например, желтый осадок 12-молибдофосфата образуется при взаимодействии фосфат-ионов с молибденовой жидкостью – раствором гептамолибдата а азотной кислоте:
7H3PO4 + 12(NH4)6Mo7O24 + 51 HNO3 = 7(NH4)3[PMo12O40]×nH2O¯ + 51NH4NO3 +
+ (3b-7n)H2O.
Эта реакция используется для качественного определения фосфат-ионов.
Классификация гетерополисоединений основана на координационном полиэдре, в котором находится гетероатом, и на отношении числа атомов металла в анионе к числу гетероатомов.
Тетраэдрические гетерополиметаллаты ряда 1:12 имеют строение, в основе которой лежит структурный элемент Mo3O10, представляющий собой три октаэдра МоО6, соединенные общими ребрами в цикл. Вся структура состоит из четырех фрагментов Мо3О10, соединенных общими вершинами в замкнутый полиэдр. В центре его находится тетраэдрическая полость, занимаемая гетероатомом. В ней могут быть размещены атомы многих неметаллов, имеющих тенденцию к тетраэдрической координации: фосфор, мышьяк, кремний, германий, бор, а также некоторых двухвалентных металлов, например, марганца(II) и кобальта(II). Эта структура была впервые установлена Дж. Кеггиным для 12-молибдофосфата аммония и носит его имя (рис.5.25. а. Строение гетерополианионов: (а) Структура Кеггина [PMo12O40]3–, (б) [Co4(PW9O34)2(H2O)2]10– , (в) структура Доусона [P2W18O62]6–, (г) Структура Андерсона [Cr(OH)6Mo6O18]3–, (д) [MnMo9O32]6–)×. Соединения со структурой Кеггина устойчивы и не разлагаются концентрированными минеральными кислотами, поскольку вводимые протоны не разрушают связей М–О–М, а гетероатом надежно защищен от внешнего вздействия. Синтез их ведут в сильнокислой среде. Из раствора, полученного взаимодествием фосфорной кисоты с молибденовым ангидридом, могут быть выделены желтые октаэдрические кристаллы 12-молибдофосфорной кислоты Н3[PMo12O40]:
Н3PO4 + 12MoO3 + nH2O = Н3[PMo12O40] nH2O.
Сходными свойствами обладает и 12-молибдокремниевая кислота H4[SiMo12O40], а также аналогичные вольфрамовые кислоты и их соли.
Известно большое количество структур, производных от структуры Кеггина. В простейшем случае один из октаэдров МО6 может отсутствовать – это приводит к тому, что гетероатом становится более доступным для атаки частиц, находящихся в растворе. Так построен, например, ион [W11PO39]7-, способный выступать в роли лиганда по отношению ко многим переходным металлам, например, к железу: K4[W11PO39Fe(H2O)]. Строение аниона [Co4(PW9O34)2(H2O)2]10– (рис. 5.25. б) можно представить комбинацией из двух фрагментов структуры Кеггина, каждый из которых лишен одного блоков М3О10 – они раположены по сверху и снизу - и находящейся в центре четырех октаэдров СоО6, сшитых ребрами в плоский слой.
Другим производным от структуры Кеггина является структура Доусона, в которой два такие же фрагмента структуры Кеггина соединены друг с другом напрямую (Рис. 5.25. в). Она описывает строение гетерополисоединений ряда 2:18, например, 18-вольфрамодифосфат аммония (NH4)6[P2W18O62] 14H2O. Зеленовато-желтые кристаллы этого вещества образуются при длительном кипячении раствора, содержащего 1 моль вольфрамата натрия и 4 моля фосфорной кислоты, и последующем его охлаждении. Структуру Доусона можно описать как два аниона со структурой Кеггина, каждый из которых лишен одного из фрагментов М3О10, срощенные в единое геометрическое тело.
Многие октаэдрические гетерополиметаллаты ряда 1:6 имеют структуру Андерсона (рис. 5.25. г), которую ученый ошибочно приписывал гептамолибдату. Соединения такого строения, например, розовый 6-молибдохромат(III) (NH4)3[Cr(OH)6Mo6O18], голубой 6-молибдониккелат(II), бесцветный 6-молибдоферрат(III) (NH4)3[Fe(OH)6Mo6O18], желтый 6-молибдородат(III), были получены позднее. Их синтез проводят из слегка подкисленных (рН = 4-5) водных растворов. Гетероатом в этом случае находится в центре кольца, образованного из шести октаэдров МО6, связанных общими ребрами. Так как катион гетероатома-металла оказывается в центре октаэдра из атомов кислорода, окраска соединений практически идентична окраске гексааквакомплексов этих металлов. Прозводной от структуры Андерсона, в которой гетероатом надежно изолирован в центре аниона, является структура 9-молибдоманганата аммония (NH4)6[MnMo9O32]×6H2O (рис. 5.25. д), оранжево-красные кристаллы которого образуются при восстановлении перманганата калия пероксидом водорода в растворе гептамолибдата при рН 4 – 4,5. Известен и темно-красный никелевый аналог этого соединения. Высокая устойчивость этих ионов и сильное экранирование гетероатома в структуре позволяют стабилизировать марганец и никель в неустойчивой степени окисления и увидеть окраску гексаакаваионов [Mn(H2O)6]4+ и [Ni(H2O)6]4+, не существующих в растворе.
Вольфрам не образует ГПС ряда 1:6 и 2:18, поскольку для него в больших полианионах характерно объединение октаэдров через общие вершины, а не ребра.
В качестве гетероатомов в гетерополисоединениях могут выступать более 50 металлов и неметаллов. Кислоты и их соли с небольшими катионами хорошо растворимы в воде, по мере увеличения размера катиона растворимость уменьшается. На этом основана очистка этих веществ перекристаллизацией или экстракцией органическими растворителями, например, диэтиловым эфиром. Твердые гетерополисоединения термически более устойчивы, чем изополиоксометаллаты, многие из них не разлагаются даже концентрированными минеральными кислотами. Это связано с тем, что сами по себе гетерополикислоты являются сильными, и поэтому протоны, введенные в систему, не разрушают связей М–О–М, объединяющих октаэдры МО6. В щелочных же средах эти связи разрушаются, и полимерные ионы превращаются в мономерные анионы 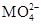 .
.
Гетерополисоединения интересны как пример высокоорганизованных веществ с высокой молекулярной массой: атомы в них строго распределены по определенным позициям. Уникальна и роль гетероатома, который не просто вмещается в готовую полость изополиметаллата, но и организует ее. В зависимости от радиуса, степени окисления и электронной конфигурации гетероатома изменяются длины связей М–О и способ соединения октаэдров МО6.
Практическое применение гетерополисоединений связано, главным образом, с их использованием в качестве катализаторов окисления непредельных углеводородов, полимеризации олефинов, эпоксидирования. Фосфорвольфрамовые кислоты являются осадителями для протеинов, алколоидов, пуринов и находят применение в качестве аналитических реагентов. На реакциях образования гетерополиоксометаллатов основано качественное определение фосфатов, арсенатов, силикатов, германатов, а также некоторых редких металлов. Гетерополисоединения молибдена находят применение в качестве замедлителей пламени. Они служат эффективными ингибиторами коррозии сталей.
Дата добавления: 2016-01-03; просмотров: 3899;
