Галогениды и оксогалогениды элементов 6-ой группы
Для соединений шестой группы известно большое количество галогенидов в различных степенях окисления (табл. 5.5.). По мере роста степени окисления, а также с уменьшением порядкового номера металла увеличивается доля ковалентности связи, а следовательно, и кислотный характер галогенида.
Дигалогениды хрома представляют собой твердые вещества с центральным атомом, расположенным в центре искаженного октаэдра, что типично для иона с конфигурацией d4 вследствие эффекта Яна-Теллера. Синтез этих соединений проводят либо восстановлением безводных тригалогенидов водородом, либо взаимодействием хрома с галогеноводородами при температуре около 1000 ºС. Иодид, единственный из дигалогенидов, может быть получен прямым синтезом. Все дигалогениды хрома растворимы в воде, где они присутствуют в виде гексаакваонов. Их водные растворы на воздухе мгновенно окисляются, изменяя окраску из ярко-синей на грязно-зеленую. Соединения хрома(II) являются сильными восстановителями, в противоположность дигалогенидам молибдена, довольно устойчивым к действию окислителей.
Недавно в среде тетрагидрофурана получен оксохлорид:
8CrCl2 + LiOH×H2O + 3C4H9Li + 4thf = 2Cr4OCl6(thf)4 + 4LiCl + 3C4H10.
Вещество представяет собой зеленые кристаллы, состоящие из тетрамерных молекул, построенных аналогично оксоацетатам двухвалентных металлов (см. т. 2), где роль мостиковых лигандов играют атомы хлора (F. A. Cotton, C. A. Murillo, I. Pascual, Inorg. Chem., 1999, 38, 2746).
Таблица 5.5. Некоторые свойства галогенидов металлов шестой группы *
| Формула | Физические свойства галогенидов | Метод получения | |||
| Фториды | Хлориды | Бромиды | Иодиды | ||
| MХ6 | CrF6, желтый, разл.>-100oC | - | - | - | 400 ºC, 300 атм 2CrF5 + F2 ¾¾¾¾¾® 2CrF6 |
| MoF6, бесцветные крист., Тпл. 17.4 оС; Ткип.34 оС | -* * | - | - | 400 ºC Mo + 3F2 ¾¾® MoF6 | |
| WF6, бесцветные крист., Ткип.=34 оС | WCl6, желтые крист., Тпл.275 оС, Ткип. 346 оС | WBr6, черно-синие крист., Тпл. 309 оС | - | 400 ºC W + 3Cl2 ¾¾® WCl6 450 ºC 3WO3 + 3CCl4 ¾® 3WCl6 +3COCl2 | |
| MХ5 | CrF5, красный, Тпл. 30 оС; Ткип. 117 оС | - | - | - | 200 ºC 2CrO3 + 5F2 ¾¾® 2CrF5 + 3O2 500 ºC 2Cr + 5F2 ¾¾® 2CrF5 |
| MoF5, желтый, Тпл. 67 оС; Ткип. 213оС | MoCl5, черный, Тпл. 194 оС; Ткип. 268оС | - | - | 400 ºC 5MoF6 + Mo ¾¾¾¾® 6MoF5 2Mo + 5Cl2 ¾¾¾® 2MoCl5 | |
| WF5, желтые крист. | WCl5, черно-зеленый, Тпл. 242 оС; Ткип. 286 оС | WBr5, черные крист. | 400 ºC WCl6 + H2 ¾¾® WCl5 +HCl | ||
| MХ4 | CrF4, фиолетовый, Тпл. 200 оС | CrCl4, газ, разлаг. выше 600 оС | CrBr4, газ | - | 350 ºC Cr + 2F2 ¾¾® CrF4 |
| MoF4, светло-зеленый | MoCl4, черный | MoBr4, черный | MoI4 | 400 ºC MoCl3 + MoCl5 ¾¾¾® 2MoCl4 60 ºC 2MoBr3 + Br2 ¾¾¾® 2MoBr4 | |
| WF4, красно-коричневый | WCl4, черный | WBr4, черный | WI4 | 450 ºC 3WCl6 + 2Al ¾¾® 3WCl4 +2AlCl3 475 ºC 3WBr5 + Al ¾¾® 3WBr4 +AlBr3 300 ºC 6WCl6 + P4 ¾¾® 6WCl4 +4PCl3 | |
| MХ3 | CrF3, зеленые крист., Тпл. 1400 оС*** | CrCl3, красно-фиолетовый, Тпл. 1150 оС | CrBr3, темно-зеленый, Тпл. 113 оС | CrI3, темно-зеленые крист. | 500 ºС CrCl3 + 3HF ¾® СrF3 + 3 HCl. 700 ºC 2Cr + 3Х2 ¾® 2CrХ3 (X = Cl, Br, I) 750 ºC Cr2O3 + C + 3X2 ¾® CrX3 + 3CO (X = Cl, Br) |
| MoF3, коричневый, Тпл.>600 oС | MoCl3, темно-коричневый, Тпл. 1027 оС | MoBr3, зеленый, Тпл. 977 оС | MoI3, черный, Тпл. 927 оС | 250 ºC MoCl5 + H2 ¾¾¾® MoCl3 + HCl 350 ºC 2Mo + 3Br2 ¾¾¾® 2MoBr3 105 ºC 2Mo(CO)6 + 3I2 ¾® 2MoI3 + 6CO | |
| - | WCl3, красные крист. | WBr3, черные крист., выше 80 оС разлаг. | WI3 | 100 ºC давл 2WCl2 + Cl2 (жидк.) ¾¾® 2WCl3 230 ºC 2WBr2 + Br2 ¾¾® 2WBr3 | |
| MХ2 | CrF2, зеленый, Тпл. 894 оС | CrCl2, белый, Тпл. 820 оС | CrBr2, белый, Тпл. 842 оС | CrI2, красно-коричн., Тпл. 868 оС | 500 ºC 2CrCl3 + H2 ¾¾® 2CrCl2 + 2HCl 850 ºC Cr + I2 ¾¾® CrI2 |
| - | MoCl2, желтые крист., выше 530 оС разлаг. | MoBr2, желто-красные крист., выше 900 оС разлаг. | MoI2, черные крист. | 610 ºC Mo + COCl2 ¾¾¾® MoCl2 + CO 650 ºC 2Mo + 3MoCl5 ¾¾¾® 5MoCl3 700 ºC MoCl2 + 2LiBr ¾® MoBr2 + 2LiCl 200 ºC, вак 2MoI3 ¾¾¾® 2MoI2 + I2 | |
| - | WCl2, желтые крист. | WBr2, желтые крист. | WI2, коричневые крист. | 500 ºC, вак 3WCl4 ¾¾¾® WCl 2 + 2WCl 5 335 ºC 3WCl6 + 4Bi ¾® 3WCl 2 + 4BiCl 5 |
* N.N. Greenwood, A. Earnshaw. Chemistry of the Elements 2d Ed. Butterworth-Heinemann. 1998. P.1019, с дополнениями авторов
** Есть непроверенные сведения об образовании МоCl6 черного цвета
* ** Плавится в закрытых системах, в открытых – диспропорционирует.
Тригалогениды хрома, молибдена и вольфрама (табл. 5.5) также существенно различаются между собой по строению и свойствам. Наиболее известен хлорный хром, или хлорид хрома(III), CrCl3, образующийся в виде фиолетовых чешуйчатых кристаллов при хлорировании хрома или смеси его оксида с углем. Это вещество может быть сублимировано в токе хлора при 600 ºС, но при нагревании до этой температуры в инертной атмосфере или в вакууме частично разлагается на дихлорид и хлор. Строение хлорного хрома можно представить как кубическую плотнейшую упаковку из атомов хлора, октаэдрические пустоты в которой на две трети заполнены атомами хрома таким образом, что вакантные пустоты образуют слои, параллельные слоям октаэдров CrCl6 ( рис.5.29 (а), Рис. 5.29 Галогениды металлов шестой группы : (а) CrCl3, (б) α-MoCl4, (в) β-MoCl4, (г) MoCl5). Это приводит к тому, что отдельные слои из октаэдров [CrCl6] оказываются связанными между собой лишь слабым Ван-дер-ваальсовым взаимодействием, что, в конечном счете, и обусловливает кристаллизацию вещества в виде тонких плоских чешуек. Благодаря электронной конфигурации d3, соединения хрома химически инертны. Именно этим объясняется тот факт, что безводные галогениды хрома(III) не растворяются в воде: попав в воду, чешуйки хлорного хрома плавают по ее поверхности, не переходя в раствор. Для приготовления раствора хлорида хрома(III) в воду требуется добавить небольшое количество соли хрома(II), либо восстановителя, например, цинка. В этом случае ионы хрома(II), находящиеся в растворе или образовавшиеся при восстановлении хрома(III) цинком, вступают во взаимодействие с хромом(III), находящимся в узлах кристаллической решетки. Обмен электронами между ионами Cr2+(раствор) и Cr3+ (кристалл CrCl3) приводит к тому, что в воде оказывается химически инертный ион трехвалентного хрома, а в узле кристаллической решетки – лабильный Cr2+, который без труда самостоятельно переходит в раствор. Процесс продолжается до тех пор, пока все ионы Cr3+ не окажутся в растворе (рис. 5.30. Растворение хлорида хрома(III) в воде). Поэтому для растворения хлорного хрома требуется лишь небольшое количество индуктора – хрома(II) или цинка. Именно таким способом хлорид хрома(III) растворяют и в других растворителях, например, в тетрагидрофуране, из которого он выделяется в виде сольвата CrCl3(thf)3. Это вещество, в отличие от безводного хлорного хрома, хорошо растворимо во многих донорных ратсворителях и является удобным исходным соединением для получения производных хрома(III) в неводных средах.
Из водных растворов хлорный хром кристаллизуется в виде гидратов. Напомним (параграф), что для них наблюдается явление ионизационной, или гидратной, изомерии:
[Cr(H2O)6]Cl3  [Cr(H2O)5Cl]Cl2×H2O
[Cr(H2O)5Cl]Cl2×H2O 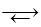 [Cr(H2O)4Cl2]Cl×2H2O
[Cr(H2O)4Cl2]Cl×2H2O
сине-фиолетовый светло-зеленый темно-зеленый
Дата добавления: 2016-01-03; просмотров: 2050;
