ДОПОЛНЕНИЕ. Галогенидные кластеры молибдена и вольфрама
Низшие галогениды молибдена и вольфрама являются кластерами, кратность связи металл-металл в которых возрастает с увеличением числа d-электронов, то есть по мере понижения степени окисления металла.
Все дигалогениды молибдена и вольфрама изоморфны и построены из шестиядерных октаэдрических кластеров [М6X8]4+ (Рис.5.31. Кластерные галогениды молибдена (а) Фрагмент полимерной структуры МоCl2, (б) Строение иона Мо2Cl93–). Из шести атомов Х, координирующих центральный атом металла, четыре экваториальных связывают октаэдры [М6X8]4+ в слои. Устойчивость кластерной группировки обусловлена наличием прочных связей М–М, в образовании которых участвуют 24 валентных электрона. Эти электроны называют кластерными скелетными электронами (КСЭ), чтобы отличить их от электронов, участвующих в образовании связей Mo–Cl. В химических реакциях кластерный ион, не изменяясь, может переходить в другие соединения. Так, при действии щелочей на дихлорид молибдена внешнесферные анионы Cl– заменяются на группы ОН. Образуется основание [Mo6Cl8](ОН)4, которое при взаимодействии с кислотами дает соли. Восемь атомов хлора, входящие в состав кластерной частицы, замещаются с трудом, например, при продолжительном нагревании с другими галогенидами. Расстояние Мо-Мо в октаэдрическом кластере находится в прямой зависимости от числа КСЭ, иными словами, от прочности связей внутри кластерной частицы (А. В. Шевельков, М. Н. Варгафтик, Металлосодержащие кластеры, Современное естетствознание, с. 254):
| Состав кластера | Строение кластера | d(Mo-Mo), нм | Число КСЭ |
| MoCl2 Cs2Mo6Cl14 HgMo6Cl14 Mo6SCl10 Mo6Br2×2H2O Mo6S6Br2 Mo6S8 | [Mo6Cl8]Cl4 Cs2[Mo6Cl8]Cl6 Hg[Mo6Cl8]Cl6 [Mo6SCl7]Cl3 [Mo6Br8]Br4(H2O)2 [Mo6S6Br2] [Mo6S8] | 0.261 0.261 0.262 0.262 0.264 0.273 0.278 |
Дихлорид молибдена представляет собой желтый порошок, устойчивый на воздухе, нерастворимый в воде, но растворимый в спирте эфире, ацетоне, концентрированных кислотах. При нагревании выше 700 оС он диспропорционирует
MoCl2 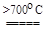 Mo + MoCl3.
Mo + MoCl3.
Галогениды молибдена и вольфрама(II) получают восстановлением высших галогенидов алюминием, амальгамой натрия, магнием, цинком, молибденом, вольфрамом, а даже такими малоактивными металлами как ртуть и висмут (V. Kolesnichenko, L. Messele, Inorg. Chem., 1998, 37, 3660). В большинстве тригалогенидов молибдена также наблюдается взаимодействие между атомами металла, о чем свидетельствует магнитные свойства этих соединений. Трихлорид молибдена изоструктурен трихлориду хрома, но с заметной долей взаимодействия Мо-Мо. Трихлорид вольфрама является типичным кластерным соединением, содержащим октаэдры W6Cl12, изоструктурные октаэдрическим кластерам в низших галогенидах ниобия и тантала (рис.) Формулу этого вещества, являющегося продуктом хлорирования дихлорида вольфрама при 100 ºС, правильнее выражает формула [W6Cl12]Cl6. Интересно, что бромирование дибромида в тех же условиях приводит к смеси продуктов, в которой обнаружены соединения W6Br14, W6Br16 и W6Br18. Все они содержат кластерную группировку [W6Br8]6–, а в качестве противоинов в них присутствуют либо ионы Br–, либо цепи Br42–, соединяющие между собой отдельные кластеры.
Электролитическое восстановление солянокислых растворов молибденового или вольфрамового ангидридов приводит к образованию красных (в случае молибдена) и зеленых (в случае вольфрама) растворов, содержащих кластерные ионы [M2Cl9]3- с кратной связью М≡М. Они представляют собой октаэдры, соединенные общей гранью (рис. 5.31 б). Кластер [Mo2Cl9] 3- имеет небольшой магнитный момент, а расстояние Mo–Mo (0.267 нм) оказывается меньше, чем в металле (0.278 нм). В то же время, комплекс [W2Cl9]3- диамагнитен, а расстояние W–W в нем 0.242 нм намного меньше, чем в металле (0.274 нм), а аналогичный хлорохромат(III)-ион содержит шесть неспаренных электронов, что доказывает отсутствие взаимодействия металл-металл. В пользу этого говорит и тот факт, что расстояние Cr–Cr в [Cr2Cl9]3- (0.312 нм) оказывается больше, чем в металлическом хроме (0.256 нм). Все это свидетельствует об увеличении взаимодействия металл-металл и прочности кластерных частиц с увеличением размеров d-орбиталей, то есть в ряду Cr – Mo – W.
КОНЕЦ ДОПОЛНЕНИЯ
Из тетрагалогенидов наиболее устойчивы фториды, известные для всех трех элементов. Хлорид хрома(IV) в виде индивидуального вещества не выделен, хотя тетраэдрические молекулы CrCl4 стабилизированы в аргоновой матрице.
Тетрахлорид молибдена MoCl4 – черное нелетучее вещество, разлагающееся выше 130 оС. Он существует в виде нескольких модификаций. В a-форме, образующейся при восстанвоении пентахлорида молибдена тетрахлорэтиленом или парами бензола, имеются линейные цепи октаэдров MoCl6, объединенных через противоположные ребра и попарно связаны взаимодействием Мо-Мо (рис. 5.29 б). Структура этого соединения аналогична тетрахлориду ниобия. Сходное строение имеет и тетрахлорид вольфрама, в нем наиболее короткие расстояния W-W (0,269 нм) приближаются к расстояниям в металле (0,274 нм) (С. И. Троянов, Е. М. Снигирева, Журн. неорг. химии, 2000, 45(4), 652; синтез, строение и свойства WCl4 опсианы также в V. Kolesnichenko, D. C. Swenson, L. Messerle, Inorg. Chem. 1998, 37, 3257). b-Moдификация MoCl4, полученная восстановлением пентахлорида молибденом, построена из циклических молекул (MoCl4)6, образованных шестью октаэдрами МоО6, связанными общими ребрами (Рис. 5.29 в). В этой структуре взаимодействия между атомами молибдена не обнаружено (U. Mueller, Angew. Chem., 1981, 93, 697). Известен также и тетрабромид молибдена (G. Pampaloni et al, J. Chem. Soc., Dalton Trans., 1993, 655). Все тетрагалогениды, за исключением тетрафторидов, легко гидролизуются и при этом диспропорционируют
2МХ4 + Н2О = МХ3 + МОХ3 + 2НХ,
а на воздухе окисляются. Частичный сольволиз проходит также и в метаноле (Anderson, L. B.; Cotton, F. A.; DeMarco, D.; Fang, A.; Ilsley, W. H.; Kolthammer, B. W. S.; Walton, R. A. J. Am. Chem. Soc. 1981, 103, 5078):
2WCl4 + 8CH3OH = [WCl2(CH3O)2(CH3OH)2]2 + 4HCl.
Из ацетонитрильных растворов WCl4 кристаллизуются сольваты, состоящие из молекул WCl4(CH3CN)2.
Пентафториды, известные для всех трех металлов, представляют собой желтые (MoF5, WF5) или красные (CrF5) легко летучие кристаллические вещества, изоструктурные соответствующим галогенидам ниобия и тантала. Они построены из циклических молекул, в которых четыре октаэдра связаны общими вершинами с помощью мостиков M–F–M (рис. 5.29 г). При небольшом нагревании пентафториды молибдена (165 оС) и вольфрама (30 оС) диспропорционируют
MF5 = MF6 + MF4.
С солями щелочных металлов они дают фторидные комплексы, например, KWF6. Пентафторид хрома при нагревании восстанавливается до тетрафторида (P. Benkič, Z. Mazej, B. Žemva, Angew. Chem. Int. Ed. Engl., 2002, 41, 1398).
Среди пентахлоридов наиболее изучен MoCl5, образующийся в виде черных кристаллов, состоящих из димеров Mo2Cl10, представляющих собой два октаэдра МоCl6, соединенных ребрами. Памагнетизм этого содеинения свидетелсьвтует об отсутствии взаимодействия металл-металл. Пентахлорид молибдена хорошо растворим во многих органических растворителях, в которых присутствует в форме мономера MoCl5. Он способен отнимать кислород от многих кислород-содержащих растворителей, например, диметилсульфоксида, образуя связи Мо=О:
MoCl5 + 3dmso = MoOCl3(dmso)2 + (CH3)2SCl2.
При растворении MoCl5 в сжиженном сернистом газе образуется оксохлорид MoOCl3. При попадании в воду пентахлорид молибдена гидролизуется, что является доказательством его ковалентной природы.
Высшие галогениды подробно изучены лишь для молибдена и вольфрама – из гексагалогенидов хрома имеются сведения лишь о существовании фторида (H. Willner et al, Inorg. Chem., 1992, 31, 5357). При движении вниз по группе окислительная активность атомов переходного металла в высшей степени окисления понижается, что приводит к увеличению устойчивости галогенидов. Гексафторид хрома устойчив лишь при низких температурах и высоких давлениях, при вскрытии ампулы он диссоциирует на пентафторид и фтор:
2CrF6 = 2CrF5 + F2
С ростом восстановительной активности галогенид-ионов, то есть в ряду F– < Cl– < Br– < I–, устойчивость галогенидов металлов в высоких степенях окисления уменьшается. Так, гекса- и пентаиодиды вообще не описаны, бромиды получены лишь для вольфрама, а пентахлориды известны как для вольфрама, так и для молибдена. Невозможность получения высших бромида и иодида хрома связана как с неизбежностью окислительно-восстановительного взаимодействия хрома(VI) с галогенид-ионами, а также является следствием стерических затруднений, связанных с размещением вокруг атома металла крупных атомов галогенов. По этой же причине из пента- и гексагалогенидов молибдена и вольфрама неизвестно ни одного иодида и описан лишь один бромид – WBr6.
Все гексагалогениды молибдена и вольфрама построены из мономерных октаэдрических молекул МХ6. Интересно, что гексафторид молибдена MoF6 при комнатной температуре жидкий, а гексафторид вольфрама WF6 – газ, несмотря на большую молекулярную массу. Высшие хлорид и бромид вольфрама представляют собой твердые вещества. Все гексагалогениды растворимы в жидком фтороводороде, сероуглероде, ацетоне, спиртах, а также в хлор-содержащих органических растворителях. При попадании в воду они последовательно гидролизуются до оксогалогенидов, а затем – до гидратированных оксидов.
МХ6 + 2Н2О = МО2Х2 + 4НХ.
При нагревании гексафториды разлагаются
МХ6 = MX5 + 1/2X2
При взаимодействии гексафторидов с фторидами металлов образуются анионные комплексы Na2MF8, реакцию обычно проводят в среде жидкого фтороводорода или при взаимодействии паров MF6 с твердым фторидом металла.
Гексахлориды служат исходными веществами для синтеза амидных, алкоксидных комплексов, а также металлорганических соединений. Так, при взаимодействии WCl6 с диметилртутью образуется метилпентахлорвольфрам (C. Santini-Scampucci and J. G. Riess, J . Chem. Soc., Dalton Trans., 1976, 195):
CH2Cl2
WCl6 + HgMe2 ¾¾® WCl5Me + HgMeCl,
–45 °C
а с триметилалюминием – гексаметилвольфрам:
WCl6 + 2AlMe3 = WMe6 + 2AlCl3.
При избытке метиллития из него может быть получен анионный комплекс Li2[WMe8]. Обработка гексахлорида вольфрама литийдиметиламидом приводит к амидному производному W(NMe3)6, которое при растворении в спирте переходит в алкоксид W(OR)6. Короткие расстояния W–N и W–O в этих соединениях указывают на значительную долю pp-dp связывания. Молекулярная орбиталь, на которой находятся электроны p-связи, легко доступна для нуклеофильной атаки, некоторые нуклефильные реагенты, например, СО2, способны внедряться по месту связи W–N. Это приводит к образованию N,N-диметикарбамата при выдерживании гексадиметиламидовольфрама в атмосфере углекислого газа даже при комнатной температуре:
W(NМe2)6 + 3CO2 = fac-[W(OC(О)NМe2)3(NМe2)3]
(M. H. Chisholm and M. W. Extine, J. Amer. Chem. Soc., 1974, 96, 6214). Реакции такого типа называют реакциями внедрения (английский термин insertion). Они характерны для химии многих тяжелых переходных элементов.
Оксогалогениды известны для всех трех элементов, но наиболее характерны для молибдена и вольфрама. Часто они выделяются в качестве побочных продуктов при синтезе безводных галогенидов. Поскольку двойная связь М═О очень прочна, оксогалогениды образуются в присутствии даже незначительного количества кислорода и водяного пара. Общим методом их синтеза является галогенирование оксидов:
1000 ºC
Cr2O3 + CrCl3 ¾¾¾→ 3CrOCl,
300 ºC
MoO2 + Cl2 ¾¾¾→ MoO2Cl2,
200 ºC
WO3 + 2SOCl2 ¾¾¾→ WOCl4 + 2SO2
400 ºC
2WO3 + WCl6 ¾¾¾→ 3WO2Cl2.
Низшие оксогалогениды могут быть также получены восстановлением или разложением высших:
140 ºC
3WOCl4 + Al ¾¾¾→ 3WOCl3 + AlCl3.
120 ºC
2MoOCl4 ¾¾¾→ 2MoOCl3 + Cl2.
Для хрома наиболее характерны высшие диоксогалогениды CrO2X2, известные для всех галогенов, за исключением иода и астата. Они имеют молекулярное строение.
Среди высших монооксогалогенидов описан лишь фторид CrOF4, образующий темно-красные кристаллы, плавящиеся при 55 ºС. Он образуется при прямом фторировании хромового ангидрида или при взаимодействии CrO2F2 с дифторидом криптона в жидком фтороводороде. Являясь кислотой Льюиса, он образует соли, например, Cs[CrOF5]. Оксохлорид хрома (V) CrOCl3 получают взаимодействием хромового ангидрида с хлористым тионилом.
Из оксогалогенидов молибдена следует отметить оксохлорид MoOCl3 – темно-коричневые игольчатые кристаллы, состоящие из бесконечных цепей, образованных октаэдрами MoOCl5, соединенных ребрами (рис. 5.32. Строение (а) MoOCl3, (б) [MoOCl5]–). При растворении их в концентриованной соляной кислоте образуются зеленые растворы, содержащие ионы [MoOCl5]–, имеющие геометрию неправильного октаэдра (рис. 5.32 б). При концентрировании из них кристаллизуются твердые оксопентахлоромолибдаты(V), например, (NH4)2[MoOCl5]. Эти вещества получают также электрохимическим восстановлением гидратированного оксида молибдена в солянокислом растворе или восстановлением молибдатов иодоводородом в концентрированной HCl:
2(NH4)2MoO4 + 2HI + 10HCl = (NH4)2[MoOCl5] + I2 + 6H2O.
В воде изумрудно-зеленые кристаллы оксопентахлоромолибдатов(V) полностью гидролизуются, давая коричневые растворы, содержащие оксо- и гидроксокатионы молибдена(V). Оксохлоромолибдаты устойчивы на воздухе и служат исходными веществами для синтеза многих соединений молибдена в низших степенях окисления.
Все оксогалогениды проявляют кислотные свойства и гидролизуются:
MoО2Cl2 + 4NaОH = Na2MoО4 + 2NaCl + 2H2O,
CrОF4 + 3Н2О = Н2CrО4 + 4НF.
Устойчивость к гидролизу существенно возрастает при движении вниз по группе: оксогалогениды молибдена и вольфрама образуют гидраты МО2Х2(Н2О)2, в то время как соединения хрома мгновенно разлагаются водой. Это связано с ослаблением кислотных свойств высших гидроксидов этих элементов. В этом же направлении уменьшаются и окислительные свойства оксогалогенидов. Например, хлористый хромил, или диоксохлорид хрома(VI), селективно переводит циклогексан в хлорциклогексан (G. K. Cook, J. M. Mayer, J. Amer. Chem. Soc., 1994, v. 116, n. 5, p. 1855), а изобутан в хлористый трет-бутил (G. K. Cook, J. M. Mayer, J. Amer. Chem. Soc., 1995, v. 117, n. 27, p. 7139) – на этом основано его использование в качестве хлорирующего агента. Для оксохлоридов молибдена и вольфрама окислительные свойства не характерны.
Дата добавления: 2016-01-03; просмотров: 3678;
