Дополнение Молибденовые сини
(Ссылка: A. Muller, E. Krickemeyer, J. Meyer et al, Angew. Chem., Int. Ed. Engl., 1995, 34, 2122; A. Muller, C. Serain, Acc. Chem. Res., 2000, 33, 25).
Со времен Карла Шееле известно, что при восстановлении растворов молибдатов в кислой среде возникает интенсивно синее окрашивание, названное «молибденовой синью». Коллоидные растворы «синей» образуются при использовании разнообразных восстановителей, например, металлов (цинк, алюминий, молибден), гидразина, гидроксиламина, сульфитов, тиосульфатов, хлорида олова(II), хлорида молибдена(V), при пропускании через раствор сернистого газа, сероводорода, диборана, а также водорода и СО (под давлением). Добавление солей, например, хлорида аммония, приводит к разрушению коллоида и выпадению синего осадка, растворимого в ионизирующих растворителях – этаноле, этилацетате. Берцелиус приписывал ему формулу Мо5О14×nH2O, а выполненное в начале XX столетия криоскопическое определение молекулярной массы дало состав Мо3О8. Это позволяло записывать уравнения реакций их образования, например:
5K2MoO4 + 10HCl + H2S = «Mo5O14» + 10KCl + S¯ + H2O,
5(NH4)6Mo7O24 + 7SnCl2 + 44HCl = 7«Mo5O14» + 7(NH4)2SnCl6 + 16NH4Cl + 22H2О,
10K2MoO4 + N2H4 + 10H2SO4 = 2«Mo5O14» + N2 + 10K2SO4 + 12H2O.
Такие формулы «синей» до сих пор встречаются учебной литературе.
В настоящее время доказано, что сини представляют собой не гидратированные оксиды молибдена, а соли, содержащие гигантские циклические гетерополианионы, составленные из октаэдров МоО6, связанных ребрами и вершинами, в замкнутую тороидальную структуру, напоминающую автомобильную шину, например, Na26[Mo142O418(H2O)58(OH)14], Na14[Mo154O448(H2O)70(OH)14]. Часть атомов молибдена в них находится в высшей степени окисления, часть восстановлена до +5. Отдельные «кольца» соединены друг с другом связями Мо-О-Мо в цепи, параллельные одна другой (Рис. 5.26. Молибденовые сини. (а) Строение гетерополианиона [MoVI126MoV28O448(H2O)70(OH)14]14– молибденовой сини. Чтобы оценить размер полости, в центр кольца для сравнения помещена молекула фуллерена С60. (б) Цепи, образованные из циклических гетерополианионов, соединенных общими атомами кислорода).
Особенностью этих гетерополисоединений является их высокая гидрофильность, обусловленная присутствием большого числа координированных молекул воды. Благодаря высоко развитой поверхности, сини адсорбируются на угле, силикагеле, а также волокнах растительного и животного происхождения. С этим связано использование синей при крашении тканей.
При использовании в качестве восстановителя гидроксиламина образуются гетерополианионы, в которых в качестве гетероатома выступает нитрозил-группа NO, например, [Mo154O420(NO)14(H2O)70]28- . Известны также и вольфрамовые сини, имеющие сходное строение.
Образование молибденовых и вольфрамовых синей используется в аналитической химии как чувствительный тест для определения восстановителей.
Дальнейшее восстановление синей приводит к коричневым растворам, содержащим соединения молибдена в степени окисления +5.
Сини образуются также и при мягком восстановлении гетерополисоединений молибдена и вольфрама со структрой Кеггина. Процесс образования гетерополисини включает два последовательных двухэлектронных переноса и сопровождается протонированием гетерополианиона с сохранением его исходной структуры:
[PMo12O40]3– + 2e– + 2H+ ¾® [H2PMo12O40]3–,
[H2PMo12O40]3– + 2e– + 2H+ ¾® [H4PMo12O40]3–
При этом часть атомов молибдена понижает свою степень окисления до +5. Гетероатом в процессе восстановления не участвует. Наиболее устойчивым оказывается анион [H4PMo12O40]3–, образующийся при принятии исходной частицей четырех электронов. Он имеет интенсивно синюю окраску с максимумом поглощения при 830 нм, обусловленную d-d переходами в восстановленных атомах молибдена, а также полосой переноса заряда.
КОНЕЦ ДОПОЛНЕНИЯ
ДОПОЛНЕНИЕМолибденовые и вольфрамовые бронзы
Среди кислородных соединений элементов шестой группы интерес представляют вольфрамовые бронзы, названые так из-за металлического блеска и мпецифической окраски. Они образуются при восстановлении вольфрамата натрия водородом при температуре красного каления
2Na6H2W12O40 + 8H2 = 24Na0.5WO3 + 8H2O
или при нагревании смеси оксида вольфрама(VI) со щелочным металлом:
WO3 + 0.3Na = Na0.3WO3
Состав их в общем виде описывается формулой MxWO3, где x < 1, M - щелочной металл, а степень окисления вольфрама промежуточная между +5 и +6. Окраска вольфрамовых бронз зависит от содержания щелочного металла: при х ~ 0.9 они золотисто-желтые, при х ~ 0.5 красные, при х ~ 0.3 фиолетово-серые. Бронзы с высоким содержанием щелочного металла (x > 0.3) обладают металлической проводимостью и имеют характерный металлический блеск, при более низком содержании металла они являются полупроводниками. Металлические бронзы химически инертны – они не растворимы в воде и не взаимодействуют даже с концентрированными растворами кислот, за исключением плавиковой. При нагревании на воздухе они окисляются до вольфрамата натрия.
Вольфрамовые бронзы имеют структуру перовскита (рис. 1.19), в которой атомы вольфрама размещаются в вершинах, атомы кислорода – в середине ребер, а атомы натрия – в центре кубической ячейки. Октаэдры WO6 образует трехмерную сетку, в которой атомы W(V) и W(VI) эквивалентны. Соединение NaWO3 (х = 1) не получено, известна фаза с максимальным значением х = 0.95.
Металлическая проводимость бронз уменьшается с ростом температуры, что предполагает наличие зоны проводимости делокализованных электронов. Эта зона, по-видимому, образуется за счет перекрывания t2g-орбиталей атомов вольфрама, но не непосредственно, а через pp-орбитали атомов кислорода. В полупроводниковых бронзах ширина запрещенной зоны оказывается больше нуля. Указанное изменение совпадает с искажением структуры, при котором проводимость осуществляется уже за счет электронов, локализованных на t2g-орбиталях атомов вольфрама.
Для молибдена образование бронз менее характерно. Они менее устойчивы и получены восстановлением молибдатов при высоких (>60 кбар) давлениях. Взаимодействие оксида молибдена(VI) с дитионитом или боргидридом натрия в этиловом спирте приводит к образованию гидратированных бронз, в которых катионы щелочного металла интеркалированы между слоями в структуре МоО3 (C. X. Zhou, Y. X. Wang, L.Q. Yang, J.H. Lin, Inorg. Chem., 2001, 40, 1521) (Рис. 5. 27. Строение гидратированной молибденовой бронзы):
2MoO3 + xNa2S2O4 + 2nH2O = 2Nax(H2O)nMoO3 +2xSO2.
При 350 – 500 °C они обезвоживаются, превращаясь в вещества состава MxMoO3. Невысокая стабильность молибденовых бронз по сравнению с вольфрамовыми может быть связана с большей склонностью молибдена(V) к диспропорционированию. Для хрома бронзы не обнаружены.
КОНЕЦ ДОПОЛНЕНИЯ
5.8. Пероксиды и пероксидные комплексы элементов 6-ой группы(ссылка ко всему разделу: M. H. Dickman, M.T. Pope, Chem.. Rev., 1994, 94, 569)
Уже в середине XIX века было известно, что при действии пероксида водорода на подкисленный (2 < pH < 4) разбавленный раствор дихромата калия возникает синее окрашивание, обусловленное образованием нестабильного пероксида хрома CrO5(H2O), имеющего строение Cr(O2)2O(H2O) (рис. 5.28а; Рис. 5.28 Перекисные соединения хрома (а – е) и молибдена (ж, з): (а) Cr(O2)2O(H2O), (б) Cr(O2)2O(py), (в) Cr(O2)2O(dipy), (г) [Cr(O2)2O(H2O)]–, (д) [Cr(O2)2(NH3)3], (е) [Cr(O2)] 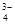 , (ж) [Mо2O3(O2)4(H2O)2]2–, (з) Mo7O22(O2)26–). Эта реакция и сейчас используется для качественного определения хрома. В индивидуальном виде пероксид хрома выделить так и не удалось, но устойчивость можно повысить экстракцией эфиром или добавлением пиридина, анилина, дипиридила; при этом происходит замещение молекулы воды на донорный лиганд (рис. 5.28 б, в):
, (ж) [Mо2O3(O2)4(H2O)2]2–, (з) Mo7O22(O2)26–). Эта реакция и сейчас используется для качественного определения хрома. В индивидуальном виде пероксид хрома выделить так и не удалось, но устойчивость можно повысить экстракцией эфиром или добавлением пиридина, анилина, дипиридила; при этом происходит замещение молекулы воды на донорный лиганд (рис. 5.28 б, в):
K2Cr2O7 + 4H2O2 + H2SO4 + Py  2CrO(O2)2Py + K2SO4 + 5H2O.
2CrO(O2)2Py + K2SO4 + 5H2O.
В слабокислой или нейтральной среде взаимодействие раствора дихромата с пероксидом водорода приводит к фиолетовому окрашиванию, обусловленному ионами [Cr(O2)2O(OH)]– (рис. 5.28 г) (S. N. Witt, D. M. Hayes, Inorg. Chem., 1982, 21, 4014). Формально их можно представить как результат депротонирования молекулы воды в пероксиде хрома Cr(O2)2O(H2O). Это подтверждает факт образования аналогичного окрашивания при действии на эфирный раствор пероксида хрома, небольшим количеством аммиака или щелочи:
Cr(O2)2O(H2O) + OH– = [Cr(O2)2O(OH)]– + H2O.
В индивидуальном виде вещество, содержащее такие ионы, может быть получено в виде аммонийной соли действием пергидроля на охлажденный раствор хромата аммония, подкисленный уксусной кислотой.
При действии на эфирный раствор пероксида хрома избытка аммиака происходит восстановление хрома до степени окисления +4: образовавшийся зеленовато-коричневый раствор содержит дипероксокомплекс [Cr(O2)2(NH3)3] (рис. 5.28. д). Это вещество также может быть получено при действии на хромовый ангидрид аммиака и крепкого раствора пероксида водорода.
В сильно щелочной среде образуются красно-коричневые растворы, содержащие тетрапероксохромат-ионы [CrV(O2)] 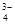 , в которых атомы кислорода образуют додекаэдр (рис. 5.28 е). Они входят в состав твердых солей, например, K3CrO8. Это вещество служит источником синглетного кислорода (Peters J.W., Bekowies P.J., Winner A.M., Pitts J.N., J. Amer. Chem. Soc., 1975, 97, 3299), а при низких температурах упорядочивается по типу антиферромагнетика (B. Cage, N. S: Dalal, Chem. Mater., 2001, 13, 880).
, в которых атомы кислорода образуют додекаэдр (рис. 5.28 е). Они входят в состав твердых солей, например, K3CrO8. Это вещество служит источником синглетного кислорода (Peters J.W., Bekowies P.J., Winner A.M., Pitts J.N., J. Amer. Chem. Soc., 1975, 97, 3299), а при низких температурах упорядочивается по типу антиферромагнетика (B. Cage, N. S: Dalal, Chem. Mater., 2001, 13, 880).
При действии пероксида водорода на растворы молибдатов и вольфраматов при рН 7 – 9 происходит замещение атомов кислорода на пероксидные группировки и образование тетрапероксокомплексов [M(O2)4]2–, окрашенных в красный (в случае молибдена) или желтый (в случае вольфрама) цвет. Они не устойчивы к разложению и, выделенные в твердом виде, взрываются при нагревании или от удара. Нагревание их водных растворов (рН 8,6 – 11,8) сопровождается выделением значительного количества синглетного кислорода. В сильно щелочной среде они разлагаются, также выделяя кислород, а при подкислении гидролизуются, превращаясь в мостиковые дипероксоанионы (Рис. 5.28 ж) :
2[M(O2)4]2– + 5H2O = [M2O3(O2)4(H2O)2]2– + 2OH– + 4H2O2.
Возможно, что диядерные пероксокомплексы образуются также и при растворении порошков молибдена и вольфрама в 30%-ном пероксиде водорода (Chakravorti M.C., Ganguly S., Bhattacharjee M., Polyhedron, 1993, 12, 55).
Интересно, что тетрапероксокомплексы образованы молибденом и вольфрамом в степени окисления +6, а хромом – в степени окисления +5. Возможно, это объясняется малым радиусом иона хрома(VI).
При добавлении пероксида водорода к растворам изополимолибдатов и изополивольфраматов образуются разнообразные изополипероксоанионы, в которых пероксидные группировки служат бидентатными концевыми (h2-) лигандами. Например, изучен пероксомолибдат-ион Mo7O22(O2)26– - аналог гептамолибдата, в котором два атома кислорода замещены на пероксидные группировки (Рис. 5.28 з).
Дата добавления: 2016-01-03; просмотров: 5109;
