ДОПОЛНЕНИЕ . Биологическая роль ванадия
Содержание ванадия в организме человека крайне мало, но некоторые низшие морские животные асцидии, по внешнему виду напоминающие губки,обладают способностью аккумулировать этот элемент в крови в особых органеллах - ванадоцитах. Содержание ванадия в этих организмах превышает его концентрацию в морской воде в десять миллионов раз! Хотя в морской воде он присутствует в виде соединений в высшей степени окисления, кровь этих существ представляет собой 0,1 – 0,2 М раствор солей ванадия(III) и ванадия(IV), находящихся в равновесии. Происходящие в крови асцидий окислительно-восстановительные процессы, связанные с обратимым переходом ванадия(III) в ванадий(IV), лежат в основе переноса кислорода.
Ванадий обладает способностью изоморфно замещать фосфор в гидроксиапатите и фторапатите, которые составляют основу зубной эмали. Это наблюдается и в некоторых природных апатитах.
Ванадий незаменим для жизнедеятельности водорослей, в которых он активирует фотосинтез. Ванадиевая нитрогеназа – ванадий-содержащий серный белок, наряду с молибденовой нитрогеназой, участвуют в процессах фиксации атмосферного азота азобактериями.
Ванадий обладает высокой биохимической активностью. Его соли активно катализируют окисление гидроксильных соединений (гидрокситриптамина, гидрокситриптофана, гидрокситирозина, адреналина и др.).
Некоторые ядовитые грибы, например, мухоморы и бледная поганка, накапливают ванадий в форме амавадина – комплекса с бис(2,2’-оксиимино)дипропионатом.
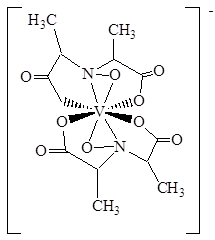
Высокая концентрация ванадия в плодовых телах этих грибов объясняется устойчивостью этого комплекса как в случае ванадия(V), так и в случае ванадия (IV). (E. M. Armstrong, R. L. Beddoes, L. J. Calviou et al, J. Amer. Chem. Soc., 1993, v. 115, p. 807).
Ванадий является важным микроэлементом для костной ткани, способствуя осаждению солей кальция и увеличивая устойчивость зубов к кариесу. В очень небольших количествах ванадий входит в состав животных и растительных организмов, включая человека. Организм здорового взрослого человека содержит примерно 10-25 мг ванадия, по большей части в костях, зубах и жировой ткани. В микроколичествах ванадий постоянно присутствует в пищевых продуктах, особенно морских, овощах и молоке. Это микроэлемент, необходимый для жизнедеятельности.
Соединения ванадия токсичны! Отравление возможно при вдыхании пыли, содержащей, например, оксид V2O5. Попадая в организм человека, соединения ванадия вызывают раздражение дыхательных путей, лёгочные кровотечения, головокружения, нарушения деятельности сердца, почек. Они накапливаются в костной ткани, в меньшей степени – в печени и селезенке.
Ниобий обнаруживается практически во всех пищевых продуктах (крупа, мясо, молочные продукты, овощи и т.д.). В средах, близких по рН к внутренним средам организма, ниобий обладает крайне малой растворимостью, что обусловливает плохое всасывание его в желудочно-кишечном тракте. В организме ниобий распределяется сравнительно равномерно. Помимо крови (считают, что связь ниобия с белками сыворотки крови имеет характер адсорбции), относительно большие количества ниобия накапливаются в мышцах, скелете, печени, почках и легких. Время, в течение которого содержание ниобия в организме уменьшается вдвое, составляет ~250 суток. Роль тантала еще мало изучена. Известно, что величина всасывания тантала из желудочно-кишечного тракта человека очень мала - это обусловлено плохой растворимостью его соединений в кишечных соках. Он очень медленно всасывается из мышечной ткани. Уникальное свойство металлического тантала – высокая биологическая совместимость. На этом свойстве основано широкое применение его в медицине, главным образом в восстановительной хирургии.
Рис. 3.2 Асцидия
КОНЕЦ ДОПОЛНЕНИЯ
Почти половину всего производимого ванадия получают при переработке железных ванадий-содержащих руд. В доменном процессе ванадий, содержащийся в руде, переходит в чугун, а затем при выплавке стали – в шлаки, в основном в форме ванадата железа(III) FeVO4. Именно они cлужат основным сырьем для производства ванадия. Смесь шлака с поваренной солью прокаливают на воздухе:
800 °C
4FeV2O4 + 8NaCl + 7O2 = 8NaVO3 + 2Fe2O3 + 4Cl2 .
При этом выделяющийся хлор вступает в реакцию со шлаком:
2FeV2O4 + 9Cl2 = 4VOCl3 + 2FeCl3 + 2O2.
Образовавшийся плав выщелачивают водой, а затем раствором серной кислоты осаждают оксид ванадия(V). Применяются и другие схемы извлечения ванадия из руд, но большинство технологических схем переработки направлено на выделение конечного продукта V2O5. В нашей стране в 30-40-х годах 20 века в разработке технологии производства ванадия принимал участие академик В.И. Спицын.
Для получения металлического ванадия оксид восстанавливают кальцием или алюминием:
V2O5 + 5Ca = 2V + 5CaO.
Добавка небольшого количества иода инициирует восстановление, так как иод поджигает кальций при температуре около 400 °C. Далее экзотермическая реакция протекает за счет своей собственной теплоты.
Для легирования сталей нет необходимости в чистом ванадии, не содержащем железа. В этом случае в качестве восстановителя используют более дешевый ферросилиций – сплав кремния с железом. Сырьем для производства феррованадия, наряду с оксидом ванадия(V), служит ванадат(V) кальция:
Ca(VO3)2 + nFe×mSi = V×nFe + CaO×mSiO2
Электролитическим рафинированием в хлоридной ванне (KCl+LiCl+VCl2) достигается очистка металлического V до 99,8-99,9 %. В менее распространенном методе восстанавливают VCl3 расплавленным магнием. Наиболее чистый металл получают иодидным методом, проводя термическое разложение летучего диодида.
Так как содержание ниобия и тантала в рудах, подвергаемых переработке, обычно не превышает сотых долей процента, на первой стадии производства руды обогащают с использованием магнитных, химических, флотационных или гравитационных методов. Полученные концентраты, представляющие собой ниобаты и танталаты различных металлов, разлагают горячей плавиковой кислотой, спекают с содой или хлорируют. Наиболее трудоемкую стадию процесса представляет разделение соединений ниобия и тантала, так как они обладают очень близкими свойствами.
Гидрофторидный метод основан на образовании различных фторидных комплексов ниобия и тантала: гептафторониобат при кипячении раствора гидролизуется, превращаясь в оксокомплекс.
4FeNb2O6 + 64HF + O2 = 4H3FeF6 + 8H2NbOF5 + 18H2O,
4FeTa2O6 + 80HF + O2 = 4H3FeF6 + 8H2TaF7 + 26H2O.
Для отделения соединений железа и других примесей к раствору добавляют гидрофторид калия. При этом комплекс K2[TaF7] выпадает в осадок, а оксофторониобат остается в растворе. Этот метод, разработанный в 1866 г М. Мариньяком, в настоящее время уступил место более совершенным методам, основанным на экстракции метилизобутилкетоном или другими растворителями.
При сплавлении ниобиево-танталового концентрата с содой или щелочью образуются смеси ниобатов и танталатов:
800 °C
4FeM2O6 + 22Na2CO3 + O2 = 4NaFeO2 + 8Na5MO5 + 22CO2, M = Nb, Ta
Эти вещества малорастворимы в воде и легко отделяются от раствора, в который переходит большинство примесей. От соединений железа и марганца осадки очищают обработкой соляной кислотой.
При хлорировании руды ниобий и тантал переходят в летучие хлориды NbCl5 и TaCl5 и могут быть легко отделены сублимацмей от хлоридов вольфрама, олова, железа, марганца, свинца и других примесей. Разделение хлоридов ниобия и тантала осуществляют ректификацией комплексов с оксохлоридом фосфора (Nb,Ta)Cl5×POCl3.
Металлические ниобий и тантал получают металлотермическим восстановлением комплексных фторидов
K2[TaF7] + 5 Na = 2 KF + 5 NaF + Ta
или оксидов
3M2O5 + 10Al = 6M + 5Al2O3, M = Nb, Ta,
восстановлением оксидов сажей или карбидами
1900 ºC
Nb2O5 + 5C = 2Nb + 5CO,
а также электролизом расплавов K2[NbF7] с добавкой KCl и NaCl, или K2[TaF7] с добавкой Ta2O5 при температуре порядка 700 ºС.
При электролизе металл выделяется на катоде вследствие восстановления катионов TaF23+, а на аноде разряжаются оксофторотанталаты, образующиеся при взаимодействии MF72 – c Ta2O5:
TaF23+ + 5e – = Ta + 2F– катод
2TaOF63– – 4e – = 2TaF6– + О2 анод
Выделяющийся кислород взаимодействует с графитовым анодом, превращаясь в оксид СО.
При алюмотермическом восстановлении металлы образуют сплав с алюминием, из которого алюминий удаляют с помощью вакуумной переплавки. В остальных случаях металлы образуются в виде порошков. Их прессуют, а затем плавят в вакуумно-дуговых печах для получения слитков.
3.3. Физические свойства простых веществ.
Ванадий – металл бледно-серого («стального») цвета со структурой типа α-железа, чрезвычайно твердый, но пластичный – он поддается шлифованию и полировке. По сравнению с титаном, ванадий имеет большую плотность (табл. 4.2) и более высокую температуру плавления. В то же время он почти в полтора раза легче железа. Введение в металл углерода позволяет существенно повысить температуру плавления: сплав, содержащий 10 % С, плавится на примерно на 1000° выше, чем чистый металл. Однако, введение углерода понижает пластичность ванадия. Металл становится хрупким также при выдерживании на воздухе или в атмосфере кислорода при повышенной температуре за счет образования твердых растворов кислорода в ванадии. Это ограничивает использование ванадиевых сплавов.
Ниобий и тантал представляют собой чрезвычайно тугоплавкие твердые ковкие металлы, по цвету напоминающие сталь. Подобно ванадию, они кристаллизуются в решетке типа α-железа. Среди металлов ниобий имеет максимальную температуру перехода в сверхпроводящее состояние (9.2 K).
Около 90% всего производимого ванадия идет на производство легированных сталей. Ванадиевые стали содержат карбиды, например, V4C3, которые, образуя мелкие кристаллиты, распределенные по всему объему металла, придают изделию высокую твердость, вязкость, упругость, износостойкость. Такие стали идут на производство брони, инструментов, пружин, рельсов. Ванадий входит также в состав магнитных сплавов, используемых в сердечниках трансформаторов, мембранах телефонных трубок.
Ниобий, подобно ванадию, служит важной легирующей добавкой к специальным сортам сталей и сплавов цветных металлов. Добавка в каждую тонну стали 200 г ниобия существенно повышает коорозиционную стойкость материала и в то же время не приводит к потере пластичности. Даже небольшие количества ниобия сильно увеличивают прочность молибдена, титана, циркония. Алюминий при введении в него всего 0,05% ниобия утрачивает способность реагировать с растворами щелочей. Стали, содержащие сотые доли процента ниобия и ванадия, применяют для изготовления труб нефтепроводов. Вплоть до 900 °C ниобий не вступает в реакцию с ураном и поэтому может быть использован в атомной энергетике для изготовления защитных оболочек ТВЭЛов. Ниобий входит в состав многих суперсплавов.
Мировое производство тантала оценивается в сотни тонн – в несколько десятков раз меньше, чем ванадия и ниобия. Значительная часть тантала идет на изготовление оксидных конденсаторов, в которых на металлические пластины нанесен тонкий слой оксида тантала(V). Благодаря высокой твердости и коррозиционной стойкости, из тантала изготавливают хирургические и зубоврачебные инструменты, оксид тантала(V) добавляют в специальные сорта стекол для повышения отражательной способности.
Таблица 4.3. Некоторые свойства металлов пятой группы
| Свойства | V | Nb | Ta |
| Температура плавления (°С) | |||
| Температура кипения (°С) | |||
| Энтальпия плавления (кДж/моль) | 17,6 | 27,2 | 31,4 |
| Энтальпия испарения (кДж/моль) | 458,6 | 696,6 | 753,1 |
| Плотность (25 °С, г/см3) | 6,11 | 8,57 | 16,65 |
| Удельное сопротивление (0 °С, Ом×см×10-6) | 24,8 | 12,5 | 12,45 |
| Стандартный электродный потенциал E° (MV/M0), В при рН = 0. | –0.25 | –0.65 | –0.81 |
| Стандартный электродный потенциал E° (MV/M3+), В при рН = 0. | 0.68 | 0.04 | – |
3.4. Химические свойства простых веществ.
Металлы пятой группы по своему химическому поведению похожи на титан, цирконий и гафний, химия которых была рассмотрена в предыдущей главе. Как и в группе титана, 3d-металл (ванадий) оказывается значительно более реакционноспособным по сравнению со своими тяжелыми аналогами. В то же время, он менее активен, чем титан, что, по-видимому, может быть связано с d3-электронной конфигурацией, обладающей повышенной устойчивостью. Так, в отличие от титана, ванадий не вступает в реакции с кислотами-неокислителями, за исключением плавиковой, с которой он взаимодействует по причине образования прочного фторидного комплекса:
2V + 12HF = 2H3[VF6] + 3H2.
Реакция с горячим концентрированныи раствором серной кислоты протекает с окислением до соединений ванадила:
V + 3H2SO4 конц = VOSO4 + 2SO2 + 3H2O.
Аналогично ведет себя разбавленная азотная кислота. Но HNO3 c плотностью выше1,35 быстро окисляет и растворяет металл:
V + 5HNO3 = HVO3 + 5NO2 + 2H2O.
Быстро и полно окисляют ванадий до высшей степени окисления также хлорная HClO4, хлорноватая HClO3, бромноватая HBrO3, иодноватая HIO3 и пероксодисерная H2S2O8 кислоты. Лучшими реагентами для перевода ванадия в растворимое состояние являются смесь азотной и плавиковой кислот или царская водка. Расплавы щелочей в окислительной среде медленно переводят металл в ванадаты. В то же время, при обычной температуре ванадий практически не подвержен действию воздуха, растворов органических кислот и щелочей, то есть обладает высокой коррозиционной стойкостью. Его химическая активность существенно усиливается при нагреванни – при красном калении ванадий интенсвно окисляется водой с выделением водорода.
Тонкоизмельченный ванадий при нагревании на воздухе или в кислороде воспламеняется, превращаясь в порошок высшего оксида. При нагревании в токе азота при 1000 °C он образует нитрид VN с водородом – в интервале температур 500 – 900 °C – гидрид VH. Известны фосфиды, карбиды, силициды и бориды ванадия, образующиеся из простых веществ в условиях повышенных температур.
Наиболее легко протекают реакции с галогенами. В атмосфере фтора нагретый ванадий превращается в высший фторид VF5, реакция с хлором приводит к тетрахлориду VCl4, с бромом – к трибромиду VBr3, а при взаимодействии с парами иода в избытке ванадия образуется дииодид VI2.
Ниобий и особенно тантал еще более устойчивы к коррозии, что в значительной степени связано с оксидной пленкой на их поверхности. При комнатной температуре ниобий медленно взаимодействует лишь со смесью азотной и плавиковой кислот, а на тантал кислоты вообще не действуют. Несколько быстрее металлы корродируют в расплавах щелочей, но и здесь скорость коррозии составляет несколько мм в год. В виде слитков ниобий и тантал при нагревании на воздухе до температуры красного каления тускнеют лишь с поверхности, далее реакция не протекает. В виде тонких порошков при 900 °C они сгорают в кислороде, превращаясь в высшие оксиды. Порошок ниобия даже воспламеняется при попадании в расплавленную селитру.
Реакция с галогенами протекает при повышенных температурах и всегда приводит к пентагалогенидам. Так, например, порошок ниобия, нагретый до красного каления, реагирует с хлором с образованием хлорида ниобия(V). При повышенных температурах металлы также взаимодействуют с серой, углеродом, азотом, сероводородом, аммиаком. Реакция с водородом является обратимой.
Дата добавления: 2016-01-03; просмотров: 1792;
