Гидроксиды, соли кислородсодержащих кислот и комплексные соединения металлов пятой группы.
При движении вниз по группе резко возрастает устойчивость высшей степени окисления. Химия водных растворов ниобия и тантала ограничена лишь соединениями в степени окисления +5, в то время как ванадий образует соединения во всех степенях окисления от +2 до высшей. Как следует из диаграммы Фроста (рис. 3.7. Диаграмма вольт-эквивалент-степень окисления для ванадия в кислой и щелочной средах), в кислой среде наиболее устойчивы соединения ванадия(IV), а в щелочной – ванадаты(V).
Соединения ванадия(II).
Восстановление подкисленных растворов соединений ванадия более высоких степеней окисления цинковой пылью или электрическим током приводит к образованию фиолетовых растворов, содержащих аквакатион [V(H2O)6]2+:
3Zn + V2O5 + 5H2SO4 = 2VSO4 + 3ZnSO4 + 5H2O.
Высаливанием спиртом из сернокислого раствора могут быть выделены фиолетовые кристаллы гексагидрата VSO4×6H2O или ванадиевого купороса VSO4×7H2O, изоструктурного семиводному сульфату железа(II). Фиолетовая окраска обусловлена поглощением видимого света при 550 нм. Из раствора KCN и спирта выделены желто-коричневые кристаллы K4[V(CN)6], содержащие стабильный комплекс [V(CN)6]4-.
В водных растворах соли ванадия(II) в слабой стпени гидролизуются:
V2+ + H2O  VOH+ + H+, K = 1.52×10–3 (25 оС)
VOH+ + H+, K = 1.52×10–3 (25 оС)
Сильными окислителями, озоном, хлоратом, хлором , солями Се(IV), пероксидами, хроматами, перманганатом, соединения ванадия(II) количественно окисляются в ванадаты(V). На воздухе соли ванадия(II) легко окисляются кислородом до соединений ванадия (Ш) и (IV):
4V2+ + О2 + 4Н+ = 4 V3+ + 2Н2О
2VSO4 + O2 = 2VOSO4.
Устойчивость к окислению иона V2+ усиливается в присутствии анионов, образующих с ним комплексные соединения. Несколько более устойчивы к окислению двойные соли M2V(SO4)2×6H2O (M = K, NH4, Rb, Cs) со структурой шенита (M2[V(H2O)6](SO4)2), называемые солями Туттона. Их высаливают спиртом из растворов, содержащих эквимолярные количества сульфатов щелочного металла и ванадия(II).
Водные растворы солей ванадия(II) даже при подкислении медленно разлагаются с выделением водорода:
2VSO4 + H2SO4 = V2(SO4)3 +H2,
но сохраняются над амальгамированным цинком.
При действии на соли ванадия(II) растворов щелочей выпадает коричневый осадок гидроксида V(OH)2, проявляющий основные свойства и очень быстро окисляющийся водой до гидроксида ванадия(III). Для получения и сохранения V(OH)2 требуется инертная или восстановительная атмосфера. Это вещество является настолько сильным восстановителем, что превращает азот воздуха и гидроксиламин в аммиак.
При взаимодействии комплекса ванадия(II), содержащего атомы хлора и этилендиамин, с азотом воздуха в пиридине с растворенным в нем бензиламином, в 1989 г был получен комплекс [L2py2V–N=N–Vpy2L2], где L – бензиламин (Рис. 3.8. Строение комплекса молекулярного азота). В нем молекула азота выступает в роли мостикового лиганда, связывающего два атома ванадия. Соляная кислота вызывает гетеролитический разрыв связи N–N и приводит к образованию иона аммония. Таким образом, азот воздуха может быть переведен в химические соединения, легко усваиваемые растениями. (Ссылка: G. J. Leigh, J. S: de Souza, Coord. Chem. Rev. 1996, 154, 71).
Восстановительная активность ванадия(II) усиливается в присутствии фторид-ионов, связывающих образующиеся ионы V3+ в прочные фторидные комплексы (Куст(VF2+) = 105). В этих условиях соли ванадия(II) способны восстанавливать некоторые металлы, например, кадмий, из их водных растворов:
2VSO4 + 12NaF + CdSO4 = Cd¯ + 3Na2SO4 + 2Na3[VF6].
Заметим, что в отсутствие фторид-ионов данная реакция протекает в обратном направлении. Ионы V2+ из растворов Sn(II), Cu(II) и Au(III) выделяют соответствующие металлы. Азотная кислота и нитраты восстанавливаются V2+ до производных аммиака, сульфиты – до сероводорода.
Несмотря на то, что ион V2+ имеет устойчивую d3-конфигурацию, его соединения достаточно лабильны. Так, при действии этилендиамина на водный раствор ванадиевого купороса образуется комплекс [V(en)3]SO4, в избытке цианида калия – гексацианованадат(II) K4[V(CN)6], а взаимодействием иодида ванадия(II) с жидким аммиаком получен аммиакат [V(NH3)6]I2. На воздухе это соединение мгновенно окисляется, превращаясь в димер [(NH3)5V–О–V(NH3)5]I4 (R. Eßmann, G. Kreiner, A. Niemann, D. Rechenbach, A. Schmieding, Z. Anorg. Allg. Chem. 622 (1996) 1161; T. Sichla, R. Niewa, U. Zachwieja, Z. Anorg. Allg. Chem. 622 (1996) 2074).
В неводных растворах VCl2 восстанавливается боргидридом до металла.
Соединения ванадия(III).
Соли ванадия(III) получают электрохимическим восстановлением солей ванадила, растворением оксида V2O3 в кислотах или сопропорционированием соединений ванадия(II) и ванадия(IV) в кислой среде:
VSO4 + VOSO4 + H2SO4 = V2(SO4)3 + H2O.
При проведении диспропорционирования между соединениями ванадия(II) и ванадия(V) сначала образуются производные V(IV) и затем - V(III).
Удобным методом синтеза служит кипячение солей ванадила с гидразином:
4VOSO4 + N2H4×H2SO4 + H2SO4 = 2V2(SO4)3 + N2 + 4H2O.
Присутствующий в водных растворах катион [V(H2O)6]3+ имеет сине-зеленую окраску (цвет «морской волны»), однако устойчив лишь в сильно кислых средах. Его спектр поглощения содержит 2 полосы (580 и 400 нм). По химическому поведению напоминает Cr3+ и склонен к образованию октаэдрических комплексов. При рН > 3 он, подобно многим другим трехзарядным ионам элементов третьего и четвертого периодов, претерпевает гидролиз, усиливающийся с повышением температуры.
У соединений ванадия(III) гидролиз протекает глубже, чем у производных ванадия(II):
V3+ + H2O  VOH2+ + H+ K1 = 1,4.10-3,
VOH2+ + H+ K1 = 1,4.10-3,
VOH2+ + H2O  V(OH)2+ + H+ K2 = 1,4.10-4,
V(OH)2+ + H+ K2 = 1,4.10-4,
2V3+ + 2H2O  V2(OH)24+ + 2H+ K3 = 1,3.10-4.
V2(OH)24+ + 2H+ K3 = 1,3.10-4.
В результате дальнейшего гидролиза при рН 3,2-3,5 двухядерный комплекс с двумя мостиковыми ОН-группами превращается в полиядерные ионы, например:
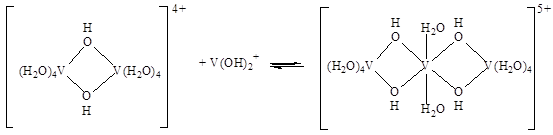 Согласно данным парамагнитного поведения этих ионов, образование в них кислородных мостиков не происходит. При увеличении степени олигомеризации углубляется коричневая окраска растворов. В растворах ацетата образуется стабильный катион [V2(OH)2(CH3COO)3]+. При понижении кислотности растворов такие ионы превращаются в коллоиды и затем коагулируют. Гидролиз может быть подавлен кислотами при концентрация ионо вводорода выше 0,4 М.
Согласно данным парамагнитного поведения этих ионов, образование в них кислородных мостиков не происходит. При увеличении степени олигомеризации углубляется коричневая окраска растворов. В растворах ацетата образуется стабильный катион [V2(OH)2(CH3COO)3]+. При понижении кислотности растворов такие ионы превращаются в коллоиды и затем коагулируют. Гидролиз может быть подавлен кислотами при концентрация ионо вводорода выше 0,4 М.
Соединения ванадия(III) неустойчивы к окислению в водных растворах, поглощают кислород и медленно окисляются до производных ванадия(IV). Добавки фосфорной кислоты Н3РО4 стабилизируют растворы солей ванадия(III), благодаря образованию более устойчивого комплекса H3[V(PO4)2]. Хлором, хлоратом, броматом, хроматом в щелочной среде, перманганатом в кислой среде соли ванадия(III) окисляются в ванадаты(V). Более слабые окислители, селеновая и селенистая кислоты, сернокислый гидразин, солянокислый гидроксиламин, переводят их в соединения ванадила, например:
NH2OH.HCl + 2VCl3 + H2O = NH4Cl + 2VOCl2 + 2HCl.
Подобно другим трехзарядным катионам, ион V3+ образует квасцы MV(SO4)2×12H2O (M = K, NH4, Rb, Cs), имеющие красно-фиолетовую окраску.
При электролитическом восстановлении раствора сульфата ванадила, содержащего избыток серной кислоты, образуется кислый сульфат V2(SO4)3×H2SO4×8H2O, выделяющийся в виде зеленого порошка при добавлении спирта. Иногда его называют дисульфатованадиевой(III) кислотой, записывая в виде HV(SO4)2×4H2O. Двойной сульфат ванадия(III) и калия КV(SO4)2 может быть получен при нагревании сульфата ванадила и сульфата калия с концентрированной серной кислотой. В этих условиях соединение ванадия(IV) диспропорционирует на V3+ и V2O5, который реагирует с концентрированной серной кислотой с выделением кислорода:
4VOSO4 + 2K2SO4 + 2H2SO4 = 4KV(SO4)2 + 2H2O + O2.
Гидроксид V(OH)3, выделяющийся при рН 4-5 в виде рыхлого грязно-зеленого осадка в результате действия щелочей, щелочных карбонатов, (NH4)2S и аммиака на соли и комплексы ванадия(III) или катодного восстановления ванадат-ионов, проявляет свойства основания – более основный, чем гидроксид Cr(III). Он постепенно переходит к оксоформу VOOH, имеющую структуру диаспора (AlOOH). Это вещество является сильным восстановителем – на воздухе легко окиcляется, становясь коричневым:
4V(OH)3 + O2 = 4VO(OH)2 + 2H2O.
Гидроксид ванадия(III) не реагирует с растворами щелочей, однако ванадаты(III) (гипованадиты) например, KVO2, изоструктурные соответствующим оксоферратам(III), могут быть получены нагреванием оксида ванадия(IV) с оксидом калия:
2K2O + 4VO2 = 2KVO2 + O2.
Ванадаты(III) щелочноземельных металлов, например, CaV2O4, имеют кристаллическую решетку шпинели.
Исходным соединением для синтеза солей ванадия(III) служит сольват трихлорида ванадия с тетрагидрофураном VCl3∙3thf, растворимый как в воде, так и в органических растворителях. Взаимодействием этого вещества с ацетатом натрия в среде уксусной кислоты получают оксиацетат ванадия(III). Подобно оксиацетатам других трехвалентных металлов (алюминия, железа, хрома, марганца), он представляет собой ионное соединение [V3O(CH3COO)6L3](CH3COO), L – молекула растворителя (F. A. Cotton, M.W: Ertine, L.R. Falvello, Inorg. Chem., 1986, 25, 3505).
Ванадий(III) образует большое количество комплексов, которые получают или по реакциям замещения:
VCl3 + 6KCN = K3[V(CN)6] + 3KCl,
или электрохимическим восстановлением соединений ванадия(V) в присутствии лиганда:
эл. ток
V2O5 + 3H2SO4 + 12KSCN = 2 K3[V(SCN)6] + 3K2SO4 + O2 + 3H2O.
Из раствора VCl3 с концентированным раствором KCN действием спирта выделены крсные кристаллы K3[V(CN)6], более лабильные, чем [VII(CN)6]4-. Из концентрированного раствора VCl3 с KSCN в спирте осаждаются кристаллы K3[V(SCN)6].4H2O. При взаимодействии концентрированного раствора V2(SO4)3 с насыщенным раствором формиата натрия образуется синий Na3[V(HCOO)6].Кристаллы гексацианованадата(III) калия окрашены в винно-красный цвет, роданидные комплексы обладают дихроизмом – в проходящем света они красные, а в отраженном – темно-зеленые, почти черные. В разбавленных растворах ион [V(SCN)6]3– превращается в аквакомплекс, что свидетельствует о лабильности соедине ний ванадия(III).
Соединения ванадия(IV).
Высокий заряд и малый радиус иона V4+ делают невозможным его присутствие в водных растворах, поэтому соединения ванадия(IV) представляют собой оксосоли. В отличие от титана(IV), в кислых водных растворах солей ванадия(IV) присутствует единственный тип катионов – ионы оксованадия(IV), или ванадила VO2+, как правило, в виде аквакомплексов [VO(H2O)5]2+, [VO(H2O)4]2+. Именно они придают этим растворам ярко-синий цвет, напоминающий окраску медного купороса. Интенсивность поглощения солями ванадила почти вдвое сильнее, чем солями V3+, и почти вчетверо сильнее, чем солями V2+. В ионе ванадила присутствует двойная связь V=O (0,155 – 0,168 нм), которая значительно короче одинарной связи (~0,23 нм).
Диаграмма молекулярных орбиталей иона [VO(H2O)5]2+ представлена на рис. (Рис. 3.9. а) Диаграмма молекулярных орбиталей иона [VO(H2O)5]2+) (Ссылка – C. J. Ballhausen, H. B. Gray, Inorg. Chem. 1962, 1, 111). В образовании связей участвуют 3d-, 4s-, 4p-орбитали атома ванадия, 2s- и 2p-орбитали атома кислорода оксо-группы и смешанные sp3-гибридные орбитали атомов кислорода молекул воды. Рx,py-Орбитали атома кислорода оксогруппы участвуют в образовании двух π-связей с dxz, dyz-орбиталями атома ванадия. Из 16 АО образуются 16 МО, шесть из которых попарно вырожденные (имеют обозначение e). Конфигурация МО имеет вид a12a22b12eσ4a32eπ4b21. Электроны располагаются на связывающих молекулярных орбиталях, преимущественно локализованных на атомах кислорода. В электронном спектре данного иона (Рис. 3.9.б. Электронный спектр водного раствора сульфата ванадила) присутствуют две полосы, соответствующие электронным переходам B2 ® E (13000 см–1) и B2 ® B1 (16000 см–1). Именно они и обусловливают синию окраску растворов солей ванадила.
Возникает вопрос, почему ионы ванадила не объединяются в димеры, тримеры и т.д., как это происходит в водных растворах солей титанила. Это объясняется тем, что энергия 3d-орбиталей титана существенно выше энергии 3d-орбиталей ванадия. Поэтому электронная плотность связи М=О в случае титана гораздо сильнее смещена к атому кислорода, то есть связь более полярна, а, следовательно, и легче протонируется: (Ti=O)2+ + H+ ® (Ti–OH)+
В кристаллогидратах солей ванадила, как правило, присутствуют изолированные ионы ванадила, имеющие форму октаэдра с одной укороченной связью V=O или квадратной пирамиды за счет координации воды или аниона. Такое строение, например, имеет сульфат VOSO4×3H2O, кристаллизующийся из горячих водных растворов в виде кристаллов небесно-голубого цвета (Рис. 3.10. Строение сульфата ванадила). Магнитный момент (μВ = 1,72) соответствует одному неспаренному электрону.
При нагревании до 280 °С кристаллы обезвоживаются, превращаясь в светло-зеленый порошок a-VOSO4, хорошо растворимый в воде. В его структуре сохраняются ионы V=O, лишь слабо взаимодействующие друг с другом: V=O…V=O… При нагревании кристаллогидрата с концентрированной серной кислотой образуется другая полиморфная модификация сульфата ванадила, b-VOSO4, в которой реализуются зигзагообразные цепи V–O–V–O–V- O, наподобие солям титанила. Это вещество по окраске напоминает a-форму, но, в отличие от нее, нерастворимо в воде. Полиморфный переход b-VOSO4 ® a-VOSO4 происходит при нагревании с небольшим количеством воды.
Соли ванадила получают восстановлением ванадиевого ангидрида в кислом растворе этиловым спиртом, щавелевой кислотой, соляной кислотой, сернистым газом, тиосульфатом, роданидом и др.:
V2O5 + H2SO4 + SO2 = 2VOSO4 + H2O.
Сульфат ванадила образуется также при длительном кипячении оксида ванадия(V) с концентрированной серной кислотой:
V2O5 + 2H2SO4 конц = 2VOSO4 + O2 + 2H2O,
при нагревании ванадатов (V) с гидразином в сернокислом растворе:
4VO3- + N2H4 + 12H+ = 4VO2+ + N2 + 8H2O,
или при восстановлении подкисленных растворов ванадатов(V) солями меди(I), железа(II).
Очень удобным методом синтеза служит сопропорционирование производных ванадия(V) и ванадия(Ш) в растворах (быстрая реакция первого порядка) или в твердом состоянии. Помимо этого, производные ванадия(IV) синтезируют окислением соединений V(Ш), например:
V2O3 + H2SeO4 = 2VO2 + H2SeO3 и далее
2V2O3 + H2SeO3 = 4VO2 + Sе + H2O.
В слабокислой, нейтральной и щелочной средах соли ванадила могут быть окислены до оксида ванадия(V) или ванадатов(V) различными окислителями:
10VOSO4 + 2KMnO4 + (7 + 5n)H2O = 5V2O5×nH2O + 2MnSO4 + K2SO4 + 7H2SO4
VOSO4 + Na2O2 + 8NaOH = 2Na3VO4 + Na2SO4 + 4H2O,
2VOSO4 + H2SO5 + 3H2O = 2HVO3 + 3H2SO4,
из фосфорномолибдатов в щелочной среде они выделяют осадок молибденовой сини.
В то же время, действием восстановителей (гидразин, металлическое серебро, гидроксиламин и др.) соединения ванадия(IV) переводятся в производные ванадия низших степеней окисления.
Водный раствор VOSO4 имеет кислую реакцию – свидетельство протекающего гидролиза. Однако, глубина протекания незначительна – для его подавления достаточно 0,02 М H2SO4. При взаимодействии VO2+ с ионами ОН– в отношении 1:1 образуется VO(ОН)+. При дальнейшем добавлении ОН– выпадает грязно-розовый осадок гидроксида VO(OH)2. Осаждение заканчивается при рН = 4,5. Оксогидроксиды ванадия(IV) найдены в природе в виде минералов - коричневого дуттонита VO(OH)2 и черного долоресита V3O4(OH)4 (или 3V2O4.4H2O). В избытке щелочи (при рН > 9) осадок растворяется с образованием желто-коричневых растворов, содержащих различные ванадат(IV)-ионы.
Кристаллический VO(OH)2 состоит из октаэдров VO6, соединенных между собой в цепи (Рис. 3.11. Строение VO(OH)2). При 200 °С он переходит в полугидрат 2VO2×H2O, а при 250 °С – в безводный оксид VO2.
Ванадаты(IV), или ванадиты, представляют собой вещества коричневого цвета, устойчивые в щелочной среде и легко окисляющиеся на воздухе. Они образуются при добавлении щелочи к осадку гидроксида оксованадия(IV):
3VO(OH)2 + 2KOH = K2V3O7 + 4H2O.
Хотя ранее в учебной литературе было принято записывать состав выделяющихся из таких растворов кристаллических солей щелочных металлов в виде тетраванадатов(IV) «M2V4O9×7H2O», исследования последних двадцати лет показали, что большинство из них имеет простейшую формулу M2V3O7×nH2O. Соли, кристаллизующиеся из водных растворов, содержат полиядерные оксоанионы V18O4212–, образованные квадратными пирамидами VO5, соединенными ребрами и вершинами в замкнутую сферическую оболочку (Рис. 4.12. Строение иона V18O4212–, устойчивого в водных растворах ванадатов(IV)). Такие ионы существуют и в щелочных растворах при рН 9 – 13. Сплавлением диоксида ванадия с гидроксидами или оксидами активных металлов получают ванадаты(IV) различного состава. Например, для кальция описаны CaV3O7, CaV4O9, CaVO3, CaV2O5. В их структуре нет отдельных ионов ванадата(IV): они состоят из квадратных пирамид VO5, соединенных общими ребрами в слои (Рис.4.13 Строение ванадатов(IV) кальция, полученных сплавлением: (а) CaV3O7, (б) CaV4O9). Атомы кальция занимают пустоты между слоями. Многие ванадаты(IV) двухвалентных металлов состава MVO3 имеют структуру перовскита.
Для ванадия(IV) характерно образование комплексных соединений с кислород-донорными и азот-донорными лигандами. В большинстве из них, например, в цианиде K2[VO(CN)4], оксалате K2[VO(C2O4)4] и ацетилацетонате VO(acac)2, присутствует связь V=O, аналогичная найденной в солях ванадила. При взаимодействии с цианидами сначала выпадает серый осадок:
VOSO4 + 2KCN = VO(CN)2 + K2SO4,
растворяющийся в избытке цианида в виде нестабильного комплекса K4[VO(CN)6]. При точных соотношениях реагентов K4[Fe(CN)6] дает желтый осадок (VO)2[Fe(CN)6] и K3[Fe(CN)6] – желто-зеленый осадок:
VOSO4 + K3[Fe(CN)6] = (VO)K[Fe(CN)6] + K2SO4.
Число комплексов ванадия(IV), не содержащих связи V=O, крайне ограничено. Их синтез проводят электрохимическим окислением соединений ванадия(III) в неводной среде или взаимодействием оксованадиевых комплексов с хлористым тионилом.
Получены оксогидроксиды ванадия со смешанными степенями окисления(+4,+5). При действии на V2O5 водорода в момент выделения выпадает зеленый гидроксид, превращающийся в черный парамагнитный порошок V6O13(OH)2.5H2O. При нагревании он разлагается
V6O13(OH)2 = V6O13 + H2O + 1/2O2,
V6O13 = 3V2O4 + 1/2O2.
Соединения ванадия(V).
Высшая степень окисления ванадия наиболее устойчива в щелочной среде. Так, ионы ванадила в щелочном растворе могут быть окислены даже таким слабым окислителем, как Fe3+:
Fe3+ + VO2+ + 6OH– = Fe2+ + VO43– + 3H2O.
В образующемся растворе присутствуют разнообразные оксоанионы, состав которых зависит от концентрации ванадия и кислотности среды. Упрощенная диаграмма различных ионных форм приведена на рис. (Рис. 3.14. Диаграмма состояния ванадия(V) в водных растворах). В сильнощелочной среде при рН > 13 в растворе присутствуют мономерные ортованадат-ионы VO43–, представляющие собой правильные тетраэдры. Им соответствуют твердые ортованадаты, например, Na3VO4, Cu2(VO4)3, которые изоструктурны аналогичным ортофосфатам. При уменьшении рН происходит протонирование ортованадата:
VO43– + H2O = HVO42– + OH–, K = 10–1
с последующим объединением (полимеризацией) отдельных тетраэдров сначала в димеры
2HVO42– = V2O74– + H2O K = 47.8,
а затем в циклические или линейные оксо-анионы:
2V2O74– + 2H2O = V4O124– + 4OH–
Они входят в состав различных метаванадатов. Так, в зависимости от рН из водных растворов ванадата(V) натрия могут быть осаждены ортованадат Ag3VO4 (pH 6,5-5,8), диванадат Ag4V2O7 (pH 5,8 – 5,5) и метаванадат AgVO3 (pH 4.5). Все эти вещества и образующие их ванадат-ионы бесцветны. В кристаллической решетке ортованадатов присутствуют изолированные ортованадат-ионы, представляющие собой правильные тетраэдры, диванадаты, часто по аналогии с фосфатами называемые пированадатами, содержат ионы V2O74–, состоящие из двух тетраэдров, связанных общей вершиной. Ни в одном из безводных метаванадатов не обнаружен ион VO3–: они содержат бесконечные цепи из тетраэдров VO4, соединенных общими атомами кислорода. В тетраметаванадах четыре таких тетраэдра объединяются в циклический ион V4O124–. Именно этот ион преобладает в водных растворах ванадатов(V) при рН 8 – 10 и концентрациях ванадия выше 0,01 моль/л.
Аналогичные процессы протекают в водных растворах ортофосфатов. О родственности строения ортофосфат- и ортованадат-ионов свидетельствует факт образования смешанного оксида VPO5 при нагревании стехиометрической смеси ортофосфорной кислоты и ванадиевого ангидрида. Из водного раствора он выделяется в виде дигидрата светло-желтого цвета.
Однако, в отличие от фосфора, для ванадия в водных растворах характерно координационное число шесть. Поэтому при определенных условиях тетраэдры [VO4], первоначально связанные общими вершинами в метаванадат-ионы, превращаются в октаэдры, которые объединяются друг с другом в полиядерные оксоанионы. Из них наиболее известен декаванадат, устойчивый в широком интервале рН от 2 до 6:
10[H2VO4]- + 6H+ = [H2V10O28]4- +12H2O, K = 6.3×1061.
Растворы, содержащие этот ион, а также и твердые декаванадаты имеют ярко-оранжевый цвет.
Движущей силой поликонденсации, с одной стороны является возрастание энтропии в результате образования большого числа молекул воды, а с другой стороны – усиление связей V-O-V за счет pπ-dπ перекрывания, особенно сильно проявляющегося при замыкании циклов. Таким образом, в растворах преобладают циклические ионы. Триванадат-ионы оказываются неустойчивыми в растворах из-за неблагоприятных величин углов V-O-V в циклических тримерах, а пентаванадаты – по статистическим причинам (Von K.H. Tytko, J. Mehmke, Z. Anorg. Allg. Chem., 1983, 503, 67).
Изучено большое число декаванадатов различных металлов, отдельные из которых, например, паскоит Ca3V10O28×17H2O, встречаются в природе в виде минералов. Ион V10O286– состоит из десяти октаэдров VO6, соединенных общими ребрами. В его основе лежат три пары октаэдров, образующие единый слой, к которому сверху и снизу примыкает еще по паре октаэдров, сочлененных общими ребрами. В результате этого возникает компактная высокосимметричная структура (Рис.3.15. Строение декаванадат-иона (а) Структура иона V10O286–, (б) Представление иона V10O286– в виде полиэдров: десять октаэдров соединены общими ребрами, два октаэдра на рисунке не видны). Декаванадат-ион и другие полиоксоанионы переходных металлов (полиоксометаллаты), структура которых состоит из октаэдров МО6, соединенных общими ребрами или гранями, называют изополианионами, а образованные ими соли – изополисоединениями.
Координационное число шесть характерно также и для гидратов метаванадатов, например, KVO3×H2O, Ca(VO3)2×2H2O, в структуре которых обнаружены сильно деформированные октаэдры VO6, соединенные общими ребрами в бесконечные цепи (Рис. 3.16. Строение твердых ванадатов. (а) диванадат-ионы в Na4V2O7, (б) триванадат-ионы в Na5V3O10; Полимерные цепи анионов в (в) KVO3×H2O, (г) KVO3). В образующихся при сплавлении оксида ванадия(V) с щелочами три- (KV3O8) и пентаванадатах (K3V5O14) присутствуют либо отдельные анионы (Рис. 3.16, а, б) либо слои из сочлененных общими ребрами октаэдров или пирамид. Аналогичные им изополианионы в водных растворах не найдены. В некоторых безводных метаванадатах содержатся ионы (VO3)nn–, представляющие собой цепи из тетраэдров, соединенных общими вершинами (Рис. 3.16 г) (как в метафосфатах).
Метафосфат натрия может быть получен при взаимодействии хлорида с оксидом ванадия(V) и кислородом:
t°
2NaCl + V2O5 + H2O ¾® 2NaVO3 + 2Cl2
Образующаяся соль реагирует с аммиаком и углекислым газом аналогично хлориду натрия:
NaVO3 + NH3 + CO2 + H2O ¾® NH4VO3¯ + NaHCO3
t°
2NH4VO3¾® 2NH3 + V2O5 + H2O
Это позволяет использовать данный метод для получения соды. В отличие от стандартной технологической схемы Сольве (т.2, с. 42) это позволяет избежать образования солевых отходов, состоящих из хлорида кальция и непрорегировавшей до конца поваренной соли (M. Trypuc, K. Biatowicz, K. Mazurek, Ind.Ebg. Chem. Res., 2001, 40, 731).
При понижении рН декавандат-ион постепенно протонируется, при этом некоторые атомы кислорода, связанные с ванадием, превращаются в ОН-группы:
V10O286– + H+ = (HО)V10O275–, K = 8.7×106
(HО)V10O275– + H+ = (HО)2V10O264–, K = 2.2×104
По мере увеличения числа гидроксогрупп в этих частицах их устойчивость и заряд уменьшаются: отдельные декаванадат-ионы начинают взаимодействовать между собой, образуя ленты из связанных друг с другом общими ребрами («конденсированных») октаэдров VO6. Каждая такая лента состоит из двойного слоя октаэдров VO6, центры которых расположены на расстоянии 0,28 нм друг от друга (В. Л. Волков, Г. С. Захарова, В. М. Бондаренка, Ксерогели простых и сложных поливанадатов, Екатеринбург, УрО РАН, 2001). Между слоями внедряются молекулы воды, приводящие вследствие высокой полярности связи фрагментов V-OH к кислотной диссоциации:
V–OH + H2O ® V–O – + H3O+
Образовавшиеся соединения, условно называемые ванадиевыми кислотами, легко образуют коллоидные растворы, что препятствует выделению их в твердом виде. Твердый гидратированный оксид ванадия(V) удается осадить лишь из достаточно концентрированных растворов в виде целого ряда соединений, отличающихся степенью гидратации (Рис. 3.17. Строение гидратированного оксида ванадия(V). Со временем образовавшийся осадок часто самопроизвольно растворяется, образуя золь. Устойчивые ярко окрашенные золи могут быть получены также при вливании расплавленного ванадиевого ангидрида в воду. Благодаря возможности обратимого введения ионов лития в слоистую структуру гелей, образующихся при коагуляции золей V2O5×nH2O, ксерогели (то есть гели, высушенные на воздухе) ванадатов предложено использовать в качестве катодных материалов в литиевых аккумуляторах (см. том 2, гл. 2).
В области низких концентраций ванадия(V) в водном растворе (менее 0,001 моль/л) постепенное протонирование ортованадат-иона приводит к ортованадиевой кислоте H3VO4×2Η2Ο или VO(OH)3(H2O)2, известной лишь в сильно разбавленных растворах и устойчивой в очень узком интервале рН на границе между областями катионных и анионных форм (примерно при рН = 3,5):
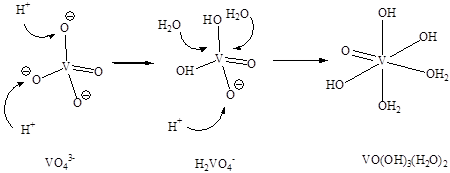
В сильнокислой среде ванадий(V) в водных растворах существует в форме моноядерных катионов диоксованадия VO2+, иногда называемых ионами ванадина:
H2V10O284– + 14H+ = 10VO2+ + 8H2O, K = 5,0×106.
Желтые растворы, содержащие ионы [VO2(H2O)4]+, достаточно устойчивы, но, как видно из рис. 3.14, при попытке выделения твердых солей разлагаются с образованием гидратированного оксида ванадия(V).
Спектральными методами доказано, что в гидратированном ионе ванадина два атома кислорода, соединенные с атомом ванадия двойной связью, находятся в цис-положении друг к другу. В среде концентрированных серной и хлорной кислот ионы диоксованадия образуют димеры:
2[VO2(H2O)4]+ + 2H+ = [V2O3(H2O)8]4+ + H2O
придающие растворам темно-красный цвет. В 13–16 М H2SO4 они полимеризуются в длинные цепи [O=V–O–(V–O)n–V=O]3n+4 (Пупкин, Inorg. Chem., 1984, 23, 469). Из водных растворов твердые соли диоксованадия не выделены. Их получают сплавлением. Например, при сплавлении оксида ванадия(V) с пиросульфатом цезия Cs2S2O7 в атмосфере кислорода (для предотвращения восстановления ванадия) получены кристаллы CsVO2SO4 (S.B. Rasmussen, S. Boghosian, et al, Inorg. Chem., 2004, 43, 3697). В отсутствие ионов щелочного металла образуется соль V2O3(SO4)2. В обоих веществах присутствуют цепочки из атомов ванадия, связанных друг с другом атомами кислорода и мостиковыми сульфатными группами.
Безводный нитрат диоксованадия(V) получают окислением металлического ванадия диоксидом азота в ацетонитриле:
V + 2N2O4 = VO2NO3 + 3NO.
Продукт реакции представляет собой кирпично-красный порошок, разлагающийся водой. При действии на высший оксид ванадия азотного ангидрида образуется тринитрат – желтая жидкость, кристаллизующаяся при 2 °C:
V2O5 + 3N2O5 = 2VO(NO3)3
Средний нитрат ванадия(V) неизвестен. (Синтезы неорганических соединений, т. 1, М., Мир, 1966, с. 178).
Таким образом, при медленном подкислении раствора ортованадата окраска постепенно изменяется от бесцветной (ортованадат, метаванадаты) до оранжевой (декаванадат и другие изополианионы), оранжево-красной (коллоидный раствор гидратированного V2О5) и, наконец, желтой, характерной для катионных оксоформ ванадия(V). Распределительная диаграмма ванадия(V) в водных растворах при различных рН представлена на рис. (Рис. 3.18. Процентное содержание различных катионных и анионных форм ванадия(V) в 0.1М растворе в зависимости от кислотности среды).
Ванадаты щелочных металлов хорошо растворимы в воде, при добавлении в такой раствор твердого хлорида аммония в присутствии аммиака осаждается бесцветный метаванадат NH4VO3, трудно растворимый в насыщенных растворах аммонийных солей. Ионы меди(II) позволяют различить растворы орто- и метаванадатов. С ортованадатами они дают синевато-зеленый, а с метаванадатами – яблочно-зеленый осадок.
Под действием восстановителей водные растворы и расплавы ванадатов(V) переходят в соединения ванадия низших степеней окисления. В водных растворах восстановление проводят в кислой среде. Восстановление ванадатов сероводородом, концентрированной соляной кислотой, сахарозой, этанолом, сернистым газом, сульфитами, щавелевой, винной и аскорбиновой кислотами, при рН ~ 2 ведет к образованию катионов VO2+:
Na6V10O28 + 18H2C2O4 = 3Na2C2O4 + 10VOC2O4 + 10CO2 + 18H2O.
Тиосульфатом соединения ванадия(V) восстанавливаются тоже до солей ванадила:
8VO3- + S2O32- + 22H+ = 8VO2+ + 2SO42- + 11H2O.
Ванадаты(V) количественно превращаются в производные ванадия(IV) при длительном кипячении их растворов. О протекании процесса свидетельствует появление синей окраски.
Иодистый водород в кислых растворах переводит ванадий(V) в ванадий(III):
NaVO3 + 3HI + 3HCl = VCl3 + I2 + NaI + 3H2O.
Зеленая окраска раствора, характерная для ионов V3+, становится заметной при удалении иода кипячением. Активные металлы, такие как цинк, алюминий, магний, кадмий, в кислой среде последовательно восстанавливают ванадат-ионы до соединений ванадия (IV), (III) и, наконец, (II). При этом бесцветный раствор (ионы VO43– или V4O124–) последовательно переходит в оранжевый (V10O286–), зеленый (смесь V10O286– и VO2+), синий (VO2+), зеленый (V3+) и фиолетовый (V2+). Различные формы ванадия, устойчивые в водных растворах, представлены на диаграмме Пурбе (Рис.3.19. Диаграма Пурбе для ванадия).
Неполное восстановление ванадат-ионов приводит к образованию полиядерных соединений со смешанными валентностями, в которых атомы ванадия находятся в различных степенях окисления, например, +4 и +5, +3 и +4. Гексаванадатный анион [HV2VV4IVO15]3- устойчив при рН 8,7-7,5. Между рН 6,4 и 4 существуют 6 декаванадатов со смешанными валентностями (IV,V), в которых от 2 до 7 атомов VV замещены на атомы VIV. Из них стабильные только [HV7VV3IVO26]4- и [HV3VV7IVO24]4-. Смешанные(IV, V) изополианионы часто имеют сложную форму, напоминающую сферу. При облучении светом растворов ванадатов в метаноле получены изополианионы, внутри которых содержатся частицы сравнительно небольшого размера, например, Cl– , CO32– и даже VO43– (Рис. 3.20. Строение иона [V15O36(CO3)]7–) :
4V4O124– + CO32– + 4CH3OH = [V15O36(CO3)]7– + VO43– + 8OH– + 4HCHO.
(T. Yamase, K. Ohtaka, Journ. Chem. Soc. Dalton Trans., 1994, 2599).
Подобно анионам других кислородсодержащих кислот, ванадаты могут выступать в качестве лигандов. Примером такого комплекса является тетраванадат тетракисфенантролиндикобальта(II) [Co2(phen)4V4O12], образующийся при выдерживании в автоклаве при 140 °С растворов метаванадата калия, нитрата кобальта и фенантролина. Он представляет собой димер, в котором два атома кобальта связаны друг с другом тетраванадат-ионом, выступающим в роли мостикового лиганда (Рис. 3.21. Строение [Co2(phen)4V4O12] ) (R. Kuscera, R. Gyepes, L. Zurkova, Cryst. Res. Technol., 2002, 37, 8, 90).
Дата добавления: 2016-01-03; просмотров: 6751;
