Дополнение 3.3. Топливные элементы на основе диоксида циркония.
Высокая концентрация вакансий 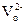 обеспечивает высокую подвижность ионов О2- и электропроводность ZrO2, легированного кальцием. Поэтому ZrO2, стабилизированный СаО, используется как твердый электролит в электрохимических датчиках для определения парциального давления кислорода, например, в выхлопных газах автомобилей (рис. 3.8 а), измерениях поглощения кислорода при дыхании, активности кислорода, растворенного в расплавах металлов, химических источниках тока и т.д.
обеспечивает высокую подвижность ионов О2- и электропроводность ZrO2, легированного кальцием. Поэтому ZrO2, стабилизированный СаО, используется как твердый электролит в электрохимических датчиках для определения парциального давления кислорода, например, в выхлопных газах автомобилей (рис. 3.8 а), измерениях поглощения кислорода при дыхании, активности кислорода, растворенного в расплавах металлов, химических источниках тока и т.д.
Пористые Pt-электроды проницаемы для кислорода в обоих направлениях. Если парциальные давления в исследуемом газе ( 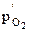 ) и со стороны электрода сравнения (
) и со стороны электрода сравнения ( 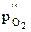 ) различаются, то возникает электродвижущая сила (э.д.с.) ячейки (Е)
) различаются, то возникает электродвижущая сила (э.д.с.) ячейки (Е)
Е = 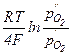 ,
,
(где Т – температура, R – универсальная газовая постоянная, F – число Фарадея), простое измерение которой позволяет определить парциальное давление кислорода 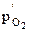 в исследуемой системе.
в исследуемой системе.
Стабилизированный ZrO2 применяется и для создания топливных элементов. Одно из электродных пространств содержит воздух или кислород, а другое – горючий газ, например, Н2 или СО. В результате реакции
Н2 + 1/2О2 ® Н2О или
СО + 1/2О2 ® СО2
между электродами создается разность потенциалов (Е, рис. 3.8 б), т.е. химическая энергия сгорания превращается в электрическую. Преимущества таких топливных элементов – отсутствие поляризации электродов, высокие плотность тока (0,5 А/см2) и удельная энергия (0,5 Вт/см2). Процесс, проходящий в топливном элементе, обратим: изменив направление тока, можно разлагать водяной пар на водород и кислород. Такие высокотемпературные электролизеры могут быть использованы для аккумулирования электроэнергии в химической форме, а также в «кислородных насосах» для выделения О2 из СО2, например, при регенерации атмосферы космических кораблей, подводных лодок и для электрохимического удаления кислорода из расплавленных металлов.
КОНЕЦ ДОПОЛНЕНИЯ
Оксиды с низкими степенями окисления наиболее устойчивы для титана. При частичном восстановлении TiO2 водородом или металлическим титаном могут быть получены дискретные фазы Магнели TinO2n-1 (4£ n £9), оксиды Ti3O5, Ti2O3 и TiO.
Фазы Магнели (названные по имени шведского исследователя А.Магнели) построены блоками с ненарушенной структурой типа ReО3 (рис. 1.18) толщиной «n» из n-октаэдров TiO6, соединенных между собой плоскостями кристаллографического сдвига (рис. 3.9).
Возникновение плоскостей кристаллографического сдвига обусловлено понижением энергии кристалла при устранении вакансий атомов кислорода, образовавшихся при частичном восстановлении TiO2. В процессе их устранения координационные полиэдры перегруппировываются, блок I сдвигается относительно блока II (рис. 3.9) таким образом, что кислородные вакансии одного блока оказываются занятыми атомами кислорода соседнего блока. Возникшую структуру называют структурой кристаллографического сдвига, в которой соседние октаэдры связываются не вершинами, а ребрами и гранями. За счет уплотнения структуры в соприкасающихся плоскостях соотношение Ti:О увеличивается без понижения координационного числа титана и образования кислородных вакансий. Структуры кристаллографического сдвига наблюдаются и в оксидах других переходных металлов.
Низшие оксиды титана могут быть получены восстановлением TiO2 углеродом, водородом, магнием, но наиболее чистые продукты получаются при использовании
металлического титана, например,
1500 °C
3TiO2 + Ti ¾¾® 2Ti2О3.
Темно-фиолетовые кристаллы Ti2O3 (TiOх, где 1.49£ х £1.51) имеют структуру корунда a-Al2О3 (рис. 4.11,т. 2), химически инертны, растворяются в кислотах-окислителях, а при нагревании диспропорционируют
Ti2O3 = TiO2 + TiO.
Повышение температуры восстановления приводит к получению оксидов с меньшим содержанием кислорода
>1500 °C
Ti2O3 + Ti ¾¾® 3TiО.
Кристаллы TiO бронзового цвета имеют структуру типа NaCl* с большим числом вакансий атомов кислорода и титана (дефекты Шоттки), что объясняет низкую плотность TiO. Оксид титана (II) растворяется в разбавленной H2SO4 с выделением Н2 и с образованием соединений титана(III):
2TiO + 3H2SO4 = Ti2(SO4)3 + H2 + 2H2O
При растворении О2 в металлическом титане образуются низшие оксиды Ti6O, Ti3O и Ti2O, в которых сохраняются связи Ti – Ti, а атомы кислорода размещены в октаэдрических узлах гексагональной плотно упакованной металлической решетки (Фукин Л. Е., Вавилова В. В., Корнилов И. И., Озеров Р. П., Соловьев С. П., Доклады АН СССР. Сер. Хим., 1970. т. 191. с. 96). Все низшие оксиды при 300-700 °C легко окисляются до TiО2.
Низшие оксиды циркония и гафния нестабильны.
3.6 Гидроксиды титана, циркония и гафния в степени окисления +4. Процессы старения осадков.
Гидроксиды элементов группы титана ЭО2×хН2О, подобно гидроксидам других переходных металлов, невозможно получить взаимодействием оксидов с водой из-за высокой прочности кристаллической решетки оксидов и, как следствие, химической инертности. При действии щелочей на водные растворы солей, содержащих катионные формы титана(IV), циркония(IV) и гафния(IV), при кипячении крепких растворов их солей, при гидролизе тетрагалогенидов часто выпадают белые студенистые осадки гидроксидов переменного состава ЭO2×хН2О. Для осаждение гидроксида титана(IV) часто требуется затравка, так как это вещество легко образует коллоидные растворы.
Данные, полученные различными методами, показывают, что гидроксиды ЭО2×хН2О содержат ОН- (гидроксо-) и –О- (оксо-) группы, а также координированные и адсорбированные молекулы воды. Чем выше содержание в гидроксидах ОН-групп, тем они более активны и реакционноспособны.
Структура гидроксидов формируется в результате сложных процессов гидролиза и поликонденсации. Рассмотрим их на примере гидроксида титана, иногда условно называемого «титановой кислотой», который образуется при гидролизе тетрахлорида титана в водном растворе аммиака. При попадании в воду молекулы TiCl4 подвергаются атаке молекул H2O, которые сначала повышают координационное число титана до 6: 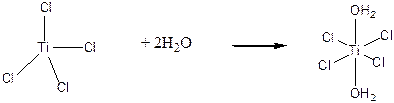
а затем вызывают разрыв связей Ti-Cl с образованием частиц [Ti(H2O)5(OH)]3+:
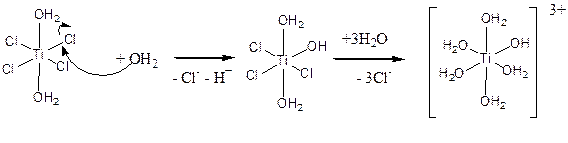
.На второй стадии гидролиза происходит поликонденсация ионов [Ti(H2O)5(OH)]3+ с образованием олигомерных гидроксо- и оксопроизводных. Простейший пример такого рода процессов иллюстрируется образованием димера, содержащего мостиковые гидроксильные группы:
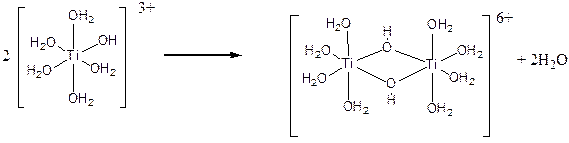
Если гидролиз проводить, прибавляя по каплям тетрахлорид титана к раствору аммиака в ледяной воде, образуется студенистый осадок (гель), содержащий значительное количество мостиковых ОН-групп (оловых мостиков). Такую свежеосажденную титановую кислоту иногда называют a-титановой кислотой. Ее брутто-состав приближенно описывается формулой α-TiО2×2Н2О. При осаждении на холоду она содержит большое число гидроксогрупп ОН и поэтому более реакционноспособна. Строение такого полимера условно можно передать формулой
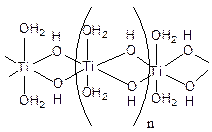
Иногда при подщелачивании солей титана осадок не образуется, так как гидроксид титана находится в состоянии коллоидного раствора. Коллоидные частицы также содержат гидроксильные мостики и соответствуют α-форме.
α-Титановая кислота растворяется в 60%-ной H2SO4:
TiO2×xH2O + H2SO4 = TiOSO4 + (x+1)H2O,
пептизуется в 40%-ном растворе NaOH. Возникающий коллоидный раствор содержит гидратированные оксополимеры титана.
Со временем осадок титановой кислоты стареет за счет превращения гидроксильных мостиков в оксоловые:
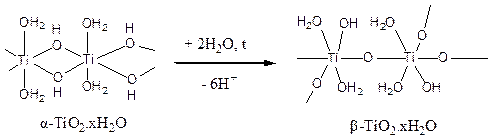
Такой процесс называют оксоляцией. Ему способствуют повышение температуры, увеличение концентрации солей титана, щелочная среда и длительное старение раствора. Оксоловый полимер (β-титановая кислота, β-TiO2×xH2O) содержит меньшее число ОН-групп и молекул воды, за счет дополнительных связей Ti-O-Ti между различными макромолекулами приобретает каркасное строение и поэтому отличается химической инертностью – не реагирует с растворами кислот и щелочей.
При последующем старении, сопровождающемся уменьшением рН растворов, образуются полиядерные оксо-комплексы, например, [Ti8O12(H2O)24]8+ (Рис. 3.10. Строение катионов оксо- и гидроксо солей, образующихся при гидролизе тетрахлоридов титана [Ti8O12(H2O)24]8+ (а) и циркония [Zr4(OH)8(H2O)16]8+ (б). Постепенно такие ионы разрастаются до размеров коллоидных частиц и, наконец, выделяются в виде гелеобразных осадков ЭО2×хН2О.
β-Титановая кислота практически сразу может быть получена при взаимодействии титана с концентрированной азотной кислотой или при нейтрализации щелочью азотнокислых растворов титана, нагретых до 85-95 оС. Это объясняется тем, что в присутствии нитрат-ионов процессы старения осадка протекают практически мгновенно, хотя их механизмы не выяснены.
При нагревании b-титановой кислоты протекает полная ее дегидратация – молекулы воды отщепляются, а все ОН-группы превращаются в оксо-мостики. Конечный продукт дегидратации - рутил TiO2 – служит сырьем для приготовления титановых белил:
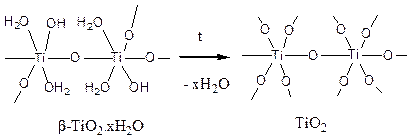
Гидроксиды циркония и гафния по многим свойствам сходны с титановыми кислотами. Они представляют собой белые студенистые осадки переменного состава, подверженные старению вследствие оксоляции. На усиление основных свойств гидроксидов при движении вниз по группе указывают минимальные значения рН, при которых удается получить осадок гидроксида действием аммиака на солянокислые растворы солей: TiО2×хН2О в зависимости от температуры раствора и концентрации соли осаждается при рН = 0,5 – 1,4; ZrО2×хН2О – при 1,9 – 2,5; HfО2×хН2О – при 2,1 – 2,9. В целом, сопоставляя свойства гидроксидов М(IV) в водных и неводных средах, можно отметить их амфотерный характер, слабое проявление кислотных и рост основных свойств в ряду Ti(IV) – -Zr(IV) – Hf(IV).
Дополнение 3.4. Коллоидные системы. Коллоидными называют системы, свойства которых определяются свойствами поверхностного слоя. Они состоят из отдельных частиц размером 1-100 нм, представляющих собой агломераты из молекул и ионов. Системы, в которых коллоидные частицы распределены в жидкости, называют золями, а сами коллоидные частицы – мицеллами. Мицеллы представляют собой сферические или пластинчатые скопления молекул, удерживаемые дисперсионными силами. Они свободно и независимо друг от друга участвуют в броуновском движении, тем самым равномерно распределяясь по всему объему раствора. В состав мицеллы входят не только собственно частица коллоидного вещества (гранула), но также молекулы растворителя и противоионы (Рис. 3.11. Схема строения мицеллы). Величина и форма мицеллы изменяются в зависимости от концентрации, температуры и присутствия других ионов.
Вокруг ядра коллоидной частицы возникает двойной электрический слой: одна его часть – это ионы, жестко закрепленные непосредственно на поверхности частицы, а вторая – противоионы, находящиеся в растворе и создающие вокруг частицы «ионную атмосферу». Таким образом, между двумя частями имеющегося двойного электрического слоя создается некоторая разность потенциалов x.
На отдельных коллоидных частицах происходит рассеяние света, именно поэтому удается проследить траекторию солнечного луча, проходящего сквозь коллоидный раствор (эффект Тиндаля). Со светорассеянием связана и опалесценция золей, то есть их мутноватый вид в отраженном свете. Некоторые вещества, например, гидроксиды переходных металлов, при осаждении образуют коллоидные растворы, которые часто можно обнаружить по едва заметной опалесценции.
 Для образования дисперсных систем необходима взаимная нерастворимость веществ, образующих систему.
Для образования дисперсных систем необходима взаимная нерастворимость веществ, образующих систему.
Коллоидные частицы под влиянием броуновского движения сталкиваются друг с другом. Очевидно, система окажется устойчивой только в том случае, когда эти столкновения будут упругими. В противном случае частицы начнут слипаться, укрупняться и, наконец, дисперсная фаза выделится из раствора в виде осадка – геля.
Процесс слипания частиц, сопровождающийся потерей устойчивости, разрушением дисперсной системы и разделением фаз (растворителя и растворенного вещества), называют коагуляцией. Коагуляция – это результат взаимодействия вандерваальсовых сил притяжения и электростатических сил отталкивания.
Суммарное действие сил притяжения и отталкивания приводит к немонотонному изменению энергии взаимодействия в зависимости от расстояния между частицами (рис. 3.12). Чем больше x-потенциал двойного электрического слоя, тем выше энергетический барьер ЕБ, препятствующий слипанию частиц. В такой ситуации частицы отталкиваются друг от друга, и коллоидный раствор (золь) оказывается устойчивым. Введение в коллоидную систему электролита приводит к отталкиванию частиц из-за уменьшения толщины «ионной атмосферы» и, соответственно, величин x и ЕБ. Барьер ЕБ практически исчезает, и любое столкновение ведет к слипанию частиц – наступает коагуляция. Если к такой системе продолжать добавлять электролит, то может происходить перезарядка двойного электрического слоя. Отталкивание между частицами вновь усиливается, и выпавший осадок (гель) повторно переходит в золь.
Самопроизвольное образование коллоидного раствора при добавлении к гелю каких-либо веществ, например, электролитов, называют пептизацией. Явление пептизации, т.е образования золей, наблюдается при добавлении свежеосажденного гидроксида титана TiО2×хН2О к раствору щелочи, а также раствора растворимого стекла Na2SiО3 к соляной кислоте.
Коллоидные системы играют важнейшую роль в процессах жизнедеятельности, в геохимии и геологии при образовании минералов, руд, почв, а также в метеорологии при формировании атмосферных явлений (туманы, облака, атмосферные осадки).
КОНЕЦ ДОПОЛНЕНИЯ
3.7. Соли кислородных кислот титана, циркония и гафния в высшей степени окисления
В силу амфотерности свежеосажденные гидроксиды ЭO2×хН2О растворяются в кислотах и расплавленных щелочах с образованием солей. Взаимодействие с кислотами приводит к образованию гидролизованных катионных форм. Вследствие высокого заряда и малого радиуса ионы Ti4+ не способны существовать в водном растворе даже в среде концентрированной серной кислоты. Свидетельством этому служит рассмотренный выше необратимый гидролиз тетрахлорида титана, протекающий с выделением большого количества теплоты. Поэтому при взаимодействии гидроксидов ЭО2×хН2О с кислотами фактически образуются не средние соли, а соответствующие оксо- и гидроксопроизводные, например, ЭОХ2 (Х = Cl-, Br-, I-, NO3-, SO42-, Н2РО4-) или их кристаллогидраты TiOCl2×2Н2О, TiOSO4×Н2О, ZrOCl2×8Н2О, HfOCl2×8Н2О и т.д.
Кристаллизация из растворов, образующихся при взаимодействии гидроксида титана с серной кислотой, приводит к выделению солей состава TiOSO4×хH2O (х = 0 – 2), называемых солями оксотитана или титанила. В твердом виде эти соединения не содержат отдельных оксо-ионов, а состоят из слоев или цепей, в которых атомы титана связаны друг с другом кислородными (оксо-) мостиками. В гидрате TiOSO4×H2O (Рис. 3.13. а) атомы титана имеют координационное число шесть, находясь в октаэдрическом окружении атомами кислорода из оксо-групп, анионов 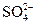 и воды, причем три атома Ti(IV) связаны с одним и тем же ионом
и воды, причем три атома Ti(IV) связаны с одним и тем же ионом 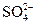 (Ahmed M. A. K., Fjellvag H., Kjekshus A., Acta Chemica Scandinavica, 1996, 50, 275). При растворении этих веществ в воде происходит разрыв некоторых связей Ti-O-Ti с образованием циклических три- и тетрамеров:
(Ahmed M. A. K., Fjellvag H., Kjekshus A., Acta Chemica Scandinavica, 1996, 50, 275). При растворении этих веществ в воде происходит разрыв некоторых связей Ti-O-Ti с образованием циклических три- и тетрамеров:
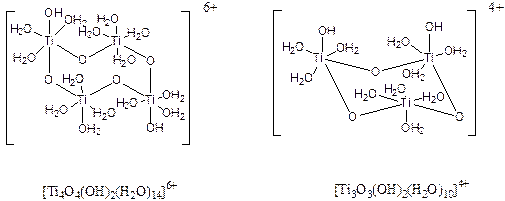
а также некоторого числа димеров и ионов титанила TiО2+, возникающих при их диссоциации:
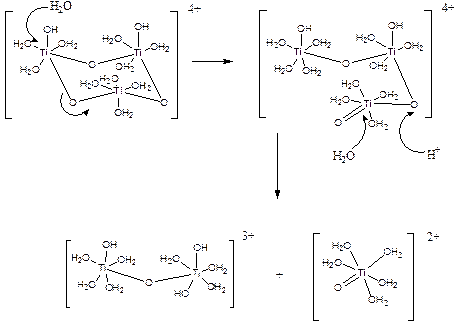
Эти выводы были сделаны на основе анализа спектров ЯМР на ядрах 17О водных растворов сульфата титанила (P. Comba, A. Merbach, Inorg. Chem. 1987, v. 26, p. 1315). Факт образования отдельных ионов TiО2+ экспериментально подтверждают данные ИК-спектроскопии (νs(Ti=O) = 974 см–1), а также наличие этой группировки (Ti=O 0,162 нм) в некоторых комплексах титана(IV) (Рис. 3.14. а Строение TiOCl2(NMe3)2), в том числе, полученных из водных растворов.
При подкислении катион титанила присоединяет протон, превращаясь в гидроксокатион [Ti(OH)(H2O)5]3+, который, протонируя другой ион титанила, превращается в [Ti(OH)2(H2O)4]2+:
[Ti(OH)(H2O)5]3+ + [TiO(H2O)5]2+ = [Ti(OH)2(H2O)4]2+ + [Ti(OH)(H2O)5]3+
Такие частицы устойчивы лишь в разбавленных подкисленных растворах солей титанила, молекулы воды в них могут замещаться анионами:
[Ti(OH)(H2O)5]3+ + HSO4– = [Ti(OH)(HSO4)(H2O)4]2+ + H2O.
При концентрировании даже сильнокислых растворов из них выделяется титановая кислота, сначала в форме коллоидных частиц, а затем в виде осадка. Гидролиз оксо- и гидроксосолей титана(IV) усиливается также при разбавлении растворов и нагревании. Устойчивость к гидролизу удается повысить, используя комплексообразование, например, добавлением к растворам солей титанила сульфатов щелочных металлов. Из таких растворов выделяют сульфотитанаты, например, K2[Ti(SO4)3]×3H2O и K2[TiO(SO4)2]×3H2O.
Катионные и нейтральные комплексы титана(IV) часто представляют собой олигомеры с мостиковыми атомами кислорода. Примерами могут служить диядерный ацетилацетонат Ti2O2(acac)4 с мостиковыми атомами кислорода (Рис. 3.14.б), образующийся при взаимодействии бензольного раствора тетрахлорида титана с бутиратом калия и ацетилацетоном (G. D. Smith, C. N. Caughlah, J. A. Campbell, Inorg. Chem. 1972, v. 11, p. 2989) или оксалатный комплекс K2[TiO(ox)2], представляющий собой циклический тетрамер (Рис. 3.14. в) (G. M. H. Van de Velde, S. Harkema, P. J. Gellings, Inorg. Chim. Acta, 1974, v. 11, p. 243). Аммиачные комплексы титана(IV) устойчивы лишь в неводной среде, из них стоит упомянуть димер [(NH3)5Ti-O-Ti(NH3)5]I4, в котором два атома титана связаны между собой оксо-мостиком (H. Jacobs et al, Z. Anorg. Allg. Chem. 1996, 622, 2074).
Негидролизованные катионные формы Ti(IV) простого состава получают лишь в неводных средах (например, в сульфурилхлориде SO2Cl2). Так, Ti(SO4)2 синтезируют взаимодействием тетрахлорида титана с серным ангидридом
TiCl4 + 6SO3 = Ti(SO4)2 + 2S2O5Cl2
или сплавлением TiO2 с пиросульфатом калия
TiO2 + 2K2S2O7 = Ti(SO4)2 + 2K2SO4,
а нитрат Ti(NO3)4 – действием азотного ангидрида N2O5 на охлажденные безводные соли с последующей возгонкой нитрата в вакууме:
–79 °C
TiCl4 + 4N2O5 = Ti(NO3)4 + 4NO2Cl.
Эти вещества представляют собой бесцветные кристаллы, гидролизующиеся в присутствии следов влаги.
Аналогично получают и перхлорат титана:
TiCl4 + 4Cl2O6 = Ti(ClO4)4 + 2Cl2 + 4O2.
Нитрат и перхлорат титана имеют сходное молекулярное строение (Рис. 3.15. Перхлорат титана(IV): (а) строение молекулы, (б) координационный полиэдр). Атом титана в них расположен в центре восьмивершинника, образованного атомами кислорода (M. Fourati, M. Chaabouni, C. H. Belin, M. Charbonnel, J.-L. Pascal, J. Potier, Inorg. Chem. 1986, 25, 1386). Эти вещества, а также аналогичные им соединения циркония и гафния, обладают летучестью.
В ряду Ti – Zr – Hf с ростом атомного номера и увеличением степени ионности связи основность гидроксидов и устойчивость средних солей к гидролизу существенно возрастают. В строении и свойствах солей циркония и гафния отмечается много общего. Так, сульфаты М(SO4)2 или нитраты М(NO3)4 циркония и гафния, полученные по методам, описанным для аналогичных солей титана, при растворении в крепкой (6М) серной кислоте не гидролизуются, при упаривании из таких растворов кристаллизуются гидраты, например, Zr(SO4)2×4H2O. Эти вещества имеют полимерное строение, благодаря мостиковым сульфатным группам (M. E. Brahimi et al, Eur. J. Solid State Inorg. Chem. 1988, 25, 185). Недавно кристаллизацией из раствора ZrO(NO3)2 в 100 %-ой HNO3 был выделен и исследован кислый гитрат нитрата циркония, содержащий катионы [Zr(NO3)3(H2O)3]+, в которых КЧ Zr(IV) = 9. Можно предположить, что и в азотнокислом растворе Zr(NO3)4.6H2O присутствуют такие катионы. О склонности Zr(IV) к гидролизу свидетельствует тот факт что уже при 20 оС на воздухе вещество гидролизуется с отщеплением HNO3, переходя в Zr(OH)2(NO3)2.H2O.
Среди гидратированных солей Ti(IV) примеры образования комплексов, в которых атом металла не содержит в координационной сфере группы –ОН или –О-, по-видимому, отсутствуют
Как уже указывалось, подавлению гидролиза способствует наличие в растворе избытка анионов кислотных остатков. Так, упариванием при комнатной температуре над H2SO4 из азотнокислого раствора нитрата цирконила и CsNO3 кристаллизуется комплекс Cs[Zr(NO3)5], в состав которого входят анионы [Zr(NO3)5]-. В них атомы Zr(IV) проявляют рекордное, ранее не реализуемое координационное число 10, координируя 5 бидентатных нитратных групп. Пентанитроцирконатный анион присутствует и в ряде других соединений, например, в NO2[Zr(NO3)5].
При 100 °C Zr(SO4)2×4H2O теряет воду, переходя в моногидрат, а при 380 °C полностью обезвоживается. Аналогичные процессы для соли гафния происходят при более высокой температуре – 215 и 490 °C, соответственно. Дальнейшее нагревание средних сульфатов последовательно приводит к фазам оксосолей (HfOSO4 при 500 – 650 °C) и оксидов (HfO2 выше 650 °C).
Из более разбавленных растворов или при кипячении кристаллизуются гидроксосоли, например, Zr2(OH)2(SO4)3(H2O)4, Zr(OH)2SO4 (Brahimi M. E., Durand J., Cot L., Eur. Journ. Solid State Inorg. Chem., 1988, 25, 185), Zr(OH)3NO3 (Benard P., Louer D., J. Physics Chem. Solids, 1995, 56, 1345), Zr(OH)2(NO3).2H2O (Benard-Rocherulle P., Rius J., Louer D., Journ. Solid State Chem., 1997, 128, 295) с полимерной или слоистой структурой. Образующиеся при гидролизе тетрахлоридов соли МOCl2×8Н2О (М = Zr, Hf) содержат тетрамерные ионы [М4(OH)8(H2O)16]8+ (см. рис. 3.10б). В них каждый из атомов металла связан с двумя соседними посредством мостиковых ОН-групп и дополнительно окружен четырьмя молекулами Н2О. Структура твердых соединений сохраняется и в растворе.
В этих веществах нет не только отдельных ионов “ZrO2+”, но даже отсутствуют оксомостики, характерные для аналогичных соединений титана. Роль мостиковых групп в соединениях циркония и гафния выполняют гидроксильные группы ОН и анионы кислотных остатков. Так, основной сульфат циркония Zr(OH)2SO4 (Рис. 3.13. б Строение основного сульфата циркония) сходен с аналогичной титановой солью (сульфатом титанила TiOSO4×H2O, рис. 3.13. а) лишь по стехиометрии.
Образование гидроксосолей сопровождается значительным подкислением раствора вследствие гидролиза. Косвенно об этом свидетельствует тот факт, что рН 0,5М раствора нитрата гафния изменяется от 0,51 при 20 °C до 0,30 при 100 °C. Высказано предположение, что в растворах гидроксосолей преобладает одна из двух циклических форм, которые находятся в равновесии:
2[Zr4(OH)8(H2O)16]8+  [Zr8(OH)20(H2O)24]12+ + 4H+ + 4H2O.
[Zr8(OH)20(H2O)24]12+ + 4H+ + 4H2O.
Чем кислее раствор, тем сильнее равновесие смещено влево (L. M. Toth et al, J. Amer. Chem. Soc. 1996, 118, 11529).
Кроме сульфатов и нитратов, для циркония и гафния известны и малорастворимые гелеобразные фосфаты переменного состава, которые образуются при добавлении к растворам их солей концентрированной фосфорной кислоты или фосфатов щелочных металлов. Кислые фосфаты М(НРО4)2×хH2O обладают высокой стойкостью к гидролизу и растворяются лишь в плавиковой кислоте, благодаря образованию фторидных комплексов. При нагревании выше 400 °C они отщепляют воду, переходя в дифосфаты:
Zr(HPO4)2 = ZrP2O7 + Н2О.
Из раствора гидроксида циркония в хлорной кислоте кристаллизуется оксосоль ZrO(ClO4)2×8H2O, по составу аналогичная оксохлориду и, по-видимому, также содержащая циклические тетрамеры. Нейтрализация солей циркония и гафния карбонатами щелочных металлов приводит к выделению осадков гидроксо-оксокарбонатов переменного состава, которые при большом избытке карбонат-ионов переходят в комплексы, например, Na3[ZrO(OH)3(CO3)3]. Примером силиката циркония служит природный минерал циркон ZrSiO4. При добавлении к солям циркония и гафния оксалат-ионов сначала выпадают осадки переменного состава, которые растворяются в избытке реагента, образуя анионные комплексы: Na4[Zr(CO3)4]. В отличие от титана, цирконий и гафний с ацетилацетоном в водных растворах в присутствии основания легко образуют гидраты ацетилацетонатов M(acac)4×10H2O. Взаимодействие солей циркония или гидроксида с раствором уксусной кислоты приводит к гидроксоацетатам, а реакция между безводным тетрахлоридом и кипящей 100%-ной уксусной кислотой - к тетраацетату Zr(CH3COO)4. Несколько неожиданным оказывается применение этого вещества, наряду с другими карбоксилатами циркония, в дезодорантах.
Соединения, содержащие металлы М(IV) в анионной форме – титанаты, цирконаты и гафнаты – обычно получают сплавлением соответствующих оксидов с щелочами или карбонатами:
900 °C
СаСО3 + TiO2 = CaTiO3 + СО2.
1050 °C
2KOH + 2ZrО2 = К2Zr2О5 + Н2О.
В соответствии с простейшими формулами их разделяют на ортотитанаты М 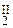 TiO4, метатитанаты MIITiO3, а также ди- (MIITi2O5), три- и тетратитанаты. Так же классифицируют цирконаты и гафнаты. В отличие от силикатов или фосфатов, даже в ортоформе этих веществ за редким исключением (Сноска: в структуре Li4TiO4 титан и литий находятся в тетраэдрическом окружении из атомов кислорода: R. P. Gunawardane et al, J. Solid State Chem. 1994, 112, 70; в Ba2TiO4 также присутствуют тетраэдры TiO4; в цирконатах и гафнатах координационное число металла всегда равно шести) не содержится изолированных ионов: атомам группы титана в кислородных соединениях свойственно координационное число шесть. В структуре этих веществ титан, цирконий и гафний находятся в центрах октаэдров, образованных атомами кислорода и объединенных общими вершинами в трехмерный каркас. В крупных пустотах каркаса располагаются щелочные или щелочноземельные катионы.
TiO4, метатитанаты MIITiO3, а также ди- (MIITi2O5), три- и тетратитанаты. Так же классифицируют цирконаты и гафнаты. В отличие от силикатов или фосфатов, даже в ортоформе этих веществ за редким исключением (Сноска: в структуре Li4TiO4 титан и литий находятся в тетраэдрическом окружении из атомов кислорода: R. P. Gunawardane et al, J. Solid State Chem. 1994, 112, 70; в Ba2TiO4 также присутствуют тетраэдры TiO4; в цирконатах и гафнатах координационное число металла всегда равно шести) не содержится изолированных ионов: атомам группы титана в кислородных соединениях свойственно координационное число шесть. В структуре этих веществ титан, цирконий и гафний находятся в центрах октаэдров, образованных атомами кислорода и объединенных общими вершинами в трехмерный каркас. В крупных пустотах каркаса располагаются щелочные или щелочноземельные катионы.
Если размеры ионов M2+ и M4+ близки (например, M4+ = Ti (0,064 нм), M2+=Mg (0,074 нм), Co (0,078 нм), Fe (0,080 нм)), то возникает структура типа ильменита FeTiO3, с гексагональной плотнейшей упаковкой ионов кислорода, октаэдрические пустоты которой заняты катионами: две трети их заполнены ионами M2+, а одна треть – ионами М4+. Структура ильменита подобна структуре корунда a-Al2O3 (рис. 3.4, т. 2), в которой вместо атомов Al поочередно расположены ионы Fe2+ и Ti4+.
Если же размер M2+ существенно больше размера M4+ (M4+ = Ti (0,064 нм), Zr (0,082 нм), Hf (0,082 нм), M2+ = Ca (0,104 нм), Sr (0,120 нм), Ba (0,138 нм), то образуется структура типа перовскита CaTiO3 (рис. 1.19, раздел 1.1).
Многие ортотитанаты и цирконаты двухвалентных металлов 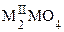 (M2+ = Mg, Zn, Mn, Fe) имеют структуру типа шпинели (см. рис. 1.21), в которой катионы занимают как тетраэдрические, так и октаэдрические пустоты в кубической плотнейшей упаковке атомов кислорода.
(M2+ = Mg, Zn, Mn, Fe) имеют структуру типа шпинели (см. рис. 1.21), в которой катионы занимают как тетраэдрические, так и октаэдрические пустоты в кубической плотнейшей упаковке атомов кислорода.
Титанаты, цирконаты и гафнаты щелочных металлов растворяются в воде, их водные растворы неустойчивы и со временем разлагаются вследствие гидролиза. Для ускорения процесса через раствор пропускают углекислый газ:
K2TiO3 + (х+1)H2O + 2CO2 = TiO2×хH2O¯ + 2KHCO3.
Соединения двух- и трехвалентных металлов в воде нерастворимы, для их разложения используют кислоты.
При длительном взаимодействии гидратированных диоксидов Ti, Zr и Hf с концентрированными растворами щелочей образуются гексагидроксокомплексы, которые содержат октаэдрические анионы [М(ОН)6]2- и могут быть выделены из растворов в виде солей с крупными катионами щелочных металлов, например, K2[Ti(OH)6], К2[Hf(ОН)6].
Восстановление титанатов щелочных металлов водородом приводит к образованию титановых бронз NaxTiO2 (x = 0.20 – 0.25) – кристаллических порошков иссиня-черного цвета, обладающих металлическим блеском и металлической проводимостью. Они имеют структуру рутила, в пустотах которой расположены атомы щелочного металла.
Дата добавления: 2016-01-03; просмотров: 3138;
