Пероксидные соединения
Для титана и его аналогов характерны комплексные соединения, в которых роль лиганда играет ион пероксида О22-. Например, при добавлении Н2О2 к подкисленным растворам солей титанила появляется характерная желто-оранжевая окраска, интенсивность которой зависит от рН среды: сильно кислые растворы окрашены в оранжево-красный цвет, слабокислые и нейтральные – в желтый. Это используется для аналитического определения соединений Ti(IV) и пероксида водорода. Появление окраски обусловлено образованием различных пероксокомплексов:
[TiO(H2O)5]2+ + H2O2  [Ti(O2)(H2O)4]2+ + 2H2O, K @ 103 – 104
[Ti(O2)(H2O)4]2+ + 2H2O, K @ 103 – 104
При повышении концентрации кислоты молекулы воды в координационной сфере титана последовательно замещаются сульфатными группами: [Ti(O2)(H2O)4]2+ 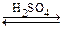 [Ti(O2)(H2O)2(SO4)]
[Ti(O2)(H2O)2(SO4)] 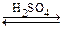 [Ti(O2)(SO4)2]2-. При упаривании раствора пероксида водорода и сульфата титанила в концентрированной серной кислоте выделяются красные кристаллы Ti(O2)(SO4)×3H2O. Высаливание этанолом желтого раствора, полученного смешением сульфата титанила с пероксидом водорода (рН = 8,6), приводит к выпадению желтого осадка пероксида титана TiO3×2H2O, строение которого неизвестно (предполагаемая структура гидропероксида титана Ti(OH)3(OOH) кажется неправдоподобной по причине низкого координационного числа титана).
[Ti(O2)(SO4)2]2-. При упаривании раствора пероксида водорода и сульфата титанила в концентрированной серной кислоте выделяются красные кристаллы Ti(O2)(SO4)×3H2O. Высаливание этанолом желтого раствора, полученного смешением сульфата титанила с пероксидом водорода (рН = 8,6), приводит к выпадению желтого осадка пероксида титана TiO3×2H2O, строение которого неизвестно (предполагаемая структура гидропероксида титана Ti(OH)3(OOH) кажется неправдоподобной по причине низкого координационного числа титана).
В сильнощелочной среде желто-оранжевое окрашивание растворов пероксидных соединений титана исчезает, а при удалении растворителя образуются анионные пероксотитанаты, например, K2[Ti(O2)(SO4)2]. Введение второй, третьей и четвертой пероксидных групп в координационную сферу титана становится возможным лишь в щелочной среде. Это приводит к образованию бесцветных растворов, содержащих комплексы [Ti(O2)2(H2O)2], [Ti(O2)3(H2O)]2– и [Ti(O2)4]4–. Из щелочных растворов в присутствии Н2О2 спиртом можно выделить кристаллические соли, содержащие четыре пероксидные группы, например, K4Ti(О2)4×6Н2О. Обычно их получают действием щелочи на пероксид титана при 0 ºC.
Из насыщенных растворов K2TiF6 в пергидроле при рН 5 – 6 кристаллизуются оранжевые кристаллы димера K4[Ti2F8(O2)2]×H2O (Рис. 3.16.а), содержащего мостиковые атомы фтора (R. Schmidt, G. Pausewang, Z. Anorg. Allg. Chem. 1988, B. 559, P. 135), а из растворов в 70 %-ном пероксиде водорода выделен светло-желтый кристаллический комплекс K3[TiF3(O2)2] (А. В. Герасименко, Б. В. Буквецкий, Б. Н. Чернышов, Н. А. Диденко, Журн. неорг. хим., 1990, Т. 35, н. 6, с. 1611). В нем атом титана находится в центре искаженной пентагональной пирамиды, образованной тремя атомами фтора и двумя пероксо-группами, лежащими в экваториальной плоскости (Рис. 3.16 б).
Цирконий и гафний, как и титан, образуют пероксиды, но, в отличие от аналогичных соединений титана, они не окрашены и не могут использоваться для аналитического определения этих металлов. Химия этих веществ практически не изучена. Известно, что при добавлении аммиака к охлажденным до 0 °C водным растворам солей циркония и гафния, содержащим избыток 30%-ного пероксида, образуются белые осадки пероксидов MO3×2H2O, по составу близкие аналогичному соединению титана. Из раствора ZrO3×2H2O в концентрированном гидроксиде калия, содержащем пероксид водорода, были выделены кристаллы K4ZrO8×6H2O.
Дата добавления: 2016-01-03; просмотров: 5207;
