Гидроксиды и соли элементов в низких степенях окисления
Устойчивость соединений элементов с низшей степенью окисления уменьшается в ряду Ti – Zr – Hf, поэтому наиболее изучены соединения титана. Темно-фиолетовый осадок гидроксида Ti(ОН)3 осаждается при действии щелочи на соли титана(III). Он не растворяется в щелочах, то есть проявляет основные свойства. Подобно другим соединениям титана(III), гидроксид Ti(ОН)3 является сильным восстановителем (см. рис. 3.1): например, восстанавливает нитрат-ион до аммиака NН3
8Ti(OH)3 + NaNO3 + 2(4х – 5)H2O = 8TiO2×хH2O + NH3 + NaОН,
а на воздухе легко окисляется
4Ti(OH)3 + O2 + (х – 6)H2O = 4TiO2×хH2O.
Соли титана(III) получают восстановлением растворов солей титанила цинком, железом или электрохимическим методом, например,
2TiOSO4 + Fe + 2H2SO4 = Ti2(SO4)3 + FeSO4 + H2О.
а также растворением металлического титана в неокисляющих кислотах. Хотя безводный сульфат титана(III) Ti2(SO4)3 – вещество зеленого цвета, его водные растворы имеет фиолетовую окраску за счет образования аква-ионов [Ti(H2O)6]3+ . С позиций теории кристаллического поля окраска аква-иона [Ti(H2O)6]3+ объясняется переходом электрона с t2g- на eg-орбиталь с поглощением энергии, соответствующей энергии расщепления
Dо = Е = 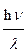 = 2.1-2.5 эВ,
= 2.1-2.5 эВ,
то есть сине-зеленой части видимого спектра (рис. 1.32, т.1 «Неорганическая химия»). Видимая же фиолетовая окраска связана с дополнительными цветами (см. также гл. 7, т. 1 и гл. 1. т. 3, «Неорганическая химия»). Ионы [Ti(H2O)6]3+ входят в состав ряда твердых кристаллогидратов, например, титановых квасцов [M(H2O)6]+[Ti(H2O)6]3+(SO4)2, где М = Rb, Cs, придавая им фиолетовую окраску.
Интересно, что кислый сульфат титана(III) Ti2(SO4)3×H2SO4×8H2O представляет собой комплексную кислоту [H5O2][Ti(SO4)2(H2O)2] (Trojanov S., Stiewe A., Kemnitz E., Zeitschrift Naturforschung, Teil B, 1996, 51, 19). В водных растворах соли титана(III) сильно гидролизованы, константа гидролиза гексаакваиона примерно равна 0,1. Вследствие высокой кислотности в водных растворах не могут быть получены многие комплексные соединения титана(III), в которых лигандами выступают анионы слабых кислот, например, цианиды. Их синтез проводят в неводных средах (G. S: Girolami, Journ. Amer. Chem. Soc., 1997, 119, 6251).
Как и гидроксид, соли титана(III) проявляют восстановительные свойства, например, обесцвечивают малиновый раствор KМnO4
5Ti2(SO4)3 + 2KMnO4 +2H2О = 10TiOSO4 + K2SO4 + 2MnSO4 + 2H2SO4.
Соединения титана(II) вследствие высокой восстановительной активности разлагают воду с выделением водорода и изучены лишь в неводных средах. Имеются сведения о том, что раствор, образующийся при взаимодействии оксида титана(II) c охлажденной соляной кислотой, в течение короткого времени содержит ионы [Ti(H2O)6]2+, при нейтрализации раствора щелочью выделяется черный осадок гидроксида Ti(OH)2. Ион Ti2+ удалось стабилизировать в матрице NaCl и изучить его спектр: в нем содержатся две полосы, отвечающие переходам 3T1g ® 3T2g и 3T1g ® 3T1g (Р), Δo = 8520 см–1. Комплексы титана(II) являются сильными восстановителями, способными вступать в реакцию с молекулой N2, образуя азот-содержащие комплексы. В некоторых из них связь между атомами азота значительно ослабевает из-за сильного взаимодействия Ti-N, соответствующего двойной связи (Ti=N–N=Ti, расстояние Ti–N 0.17 нм) (J. R. Hagadorn, J. Arnold, Journ. Amer. Chem. Soc., 1996, 118, 893). Найти r(N-N)
Гидроксиды и соли циркония и гафния в низших степенях окисления неустойчивы. В ряду Ti – Zr – Hf следует отметить усиление их основных и восстановительных свойств.
Дата добавления: 2016-01-03; просмотров: 1719;
